Les chercheurs de l'Université Case Western Reserve développent des moyens de convertir les déchets en carburants et autres produits, en utilisant des processus économes en énergie et alimentés par des sources renouvelables.
Plus précisément, ils sont sur le point de résoudre le défi de la conversion du dioxyde de carbone (CO2 ), un gaz à effet de serre majeur, en produits chimiques précieux utilisant l'électricité.
CO2 peut être une matière première utile pour fabriquer des produits chimiques et des carburants de base. Mais le processus de création de la réaction nécessaire n'est pas facile car il nécessite des pressions et des températures élevées et des matériaux spéciaux.
"Notre société moderne a un besoin crucial de technologies capables de capter le CO2 des déchets - ou même de l'air - et les convertir en produits dans des conditions inoffensives", a déclaré Burcu Gurkan, professeur de génie chimique à la Case School of Engineering. "La conversion électrochimique du dioxyde de carbone est un problème non résolu qui date de plus de 150 ans."
Jusqu'à présent, la recherche s'est principalement concentrée sur le développement de matériaux catalytiques et sur la compréhension des émissions de CO2 à forte intensité énergétique. réaction de conversion dans les électrolytes à base d’eau. Pourtant, des défis demeurent car les systèmes à base d'eau ont une capacité limitée de production de CO2. . De plus, le processus inclut des réactions secondaires indésirables, telles que des émissions d'hydrogène gazeux.
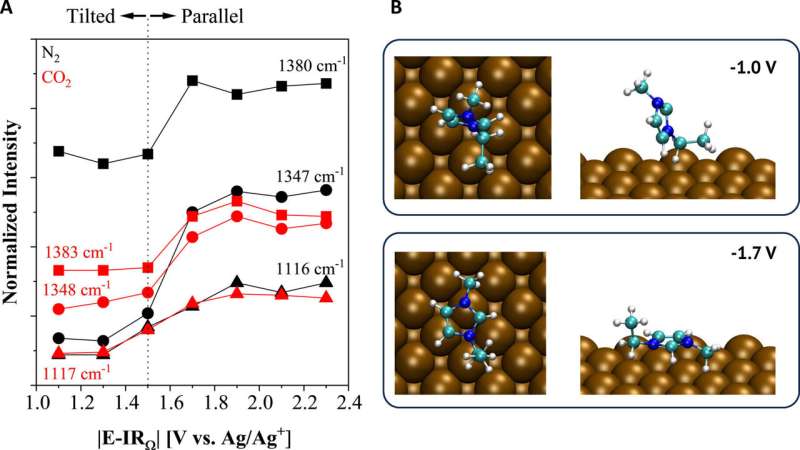
Mais dans une étude publiée cet automne dans la revue européenne Angewandte Chemie , l'équipe de recherche de Case Western Reserve a démontré que les liquides ioniques qu'ils ont développés captent et convertissent efficacement le CO2 dans un processus électrochimique.
Les liquides ioniques sont des sels qui fondent en dessous de 100°C. Ceux développés par le groupe de Gurkan sont liquides à température ambiante. Ces liquides ioniques sont également uniques en ce sens qu'ils ont une grande capacité de production de CO2 capturer et maintenir la stabilité électrochimique. En conséquence, l'équipe a réalisé le processus électrochimique souhaité.
"Notre approche se concentre sur les électrolytes liquides ioniques qui peuvent modifier la thermodynamique et la distribution du produit en raison d'effets cinétiques qui peuvent être davantage ajustés, grâce à la flexibilité de la conception des liquides ioniques", a déclaré Gurkan.
L'étude, dirigée par Oguz Kagan Coskun, doctorant dans le groupe de Gurkan, a combiné des techniques spectroscopiques et électroanalytiques pour révéler les mécanismes fondamentaux nécessaires aux liquides ioniques pour activer le CO2 réaction de réduction à la surface de l'électrode de cuivre.
Le groupe a déclaré avoir besoin de moins d'énergie pour conduire la réaction et a noté que cela pourrait conduire à la création d'une variété de produits industriellement pertinents, sans les produits secondaires indésirables trouvés dans le processus d'électrolyse traditionnel.
En outre, le rapport explique les aspects cruciaux qui influencent les propriétés de l'environnement de réaction pour l'utilisation efficace du CO2. . Ces informations supplémentaires contribuent à une compréhension plus approfondie de l'environnement réactionnel, notamment concernant les électrolytes non conventionnels.
L’équipe prévoit d’examiner plus en détail les différentes étapes de réaction pour éclairer les conceptions ultérieures d’électrolytes. Le but ultime :mieux contrôler les produits chimiques issus de la réaction et faire progresser les approches électrochimiques du CO2 recyclage.
Plus d'informations : Oguz Kagan Coskun et al, Adaptation de la réduction électrochimique du CO2 sur le cuivre par un liquide ionique réactif et des donneurs de liaisons hydrogène natifs, Angewandte Chemie (2023). DOI :10.1002/ange.202312163
Informations sur le journal : Angewandte Chemie
Fourni par l'Université Case Western Reserve