Les scientifiques de l'hôpital de recherche pour enfants St. Jude s'attaquent à la résistance aux antibiotiques de Mycobacterium abscessus (Mab). Cet agent pathogène naturellement résistant aux antibiotiques devient de plus en plus répandu, soulignant le besoin urgent de nouveaux traitements. Pour résoudre ce problème, les scientifiques ont conçu de nouvelles versions du médicament spectinomycine qui surmontent l’efflux, le principal mécanisme à l’origine de la résistance. Le travail est publié dans Proceedings of the National Academy of Science .
Les infections à Mab sont de plus en plus fréquentes dans les établissements de soins de santé. De telles infections peuvent être dangereuses pour les patients dont la fonction pulmonaire est altérée, comme dans le cas de la mucoviscidose, ou qui sont immunologiquement compromis, comme dans le cas d'un cancer infantile. Ces infections sont traitées avec de longues cures d'antibiotiques et peuvent entraîner de mauvais résultats.
L'émergence de Mab et d'autres agents pathogènes similaires présente une menace croissante et profondément préoccupante pour la santé publique, car il existe peu d'options thérapeutiques efficaces et un pipeline de développement de médicaments limité.
"Nous, les chimistes, sommes engagés dans une course contre les agents pathogènes. Nous fabriquons des antibiotiques plus puissants et les agents pathogènes deviennent plus résistants", a déclaré l'auteur correspondant Richard Lee, Ph.D., Département de biologie chimique et thérapeutique de St. Jude.
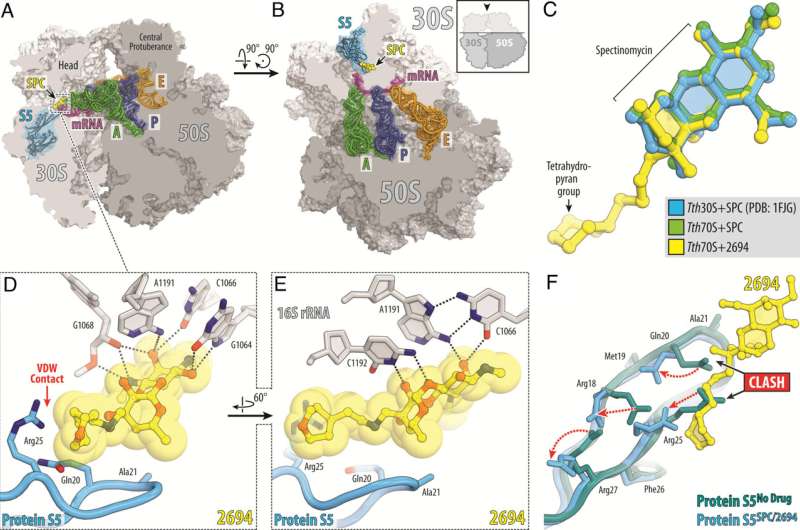
Les scientifiques de St. Jude ont modifié l'antibiotique naturel spectinomycine pour créer des analogues, comparables mais structurellement distincts, des spectinomycines aminométhylées liées au N-éthylène (eAmSPC). Ces eAmSPC créés synthétiquement sont jusqu'à 64 fois plus puissants contre Mab que la spectinomycine standard.
"En réorganisant la molécule grâce à la conception de médicaments basés sur la structure, nous et nos collaborateurs avons adapté l'antibiotique pour augmenter son activité", a ajouté Lee.
Grâce à leurs travaux, les scientifiques ont découvert le mécanisme d’action par lequel les eAmSPC sont plus efficaces :ils contournent les efflux. L'efflux est le processus que les cellules utilisent pour se débarrasser d'un médicament (imaginez pomper l'eau d'un sous-sol inondé) et constitue un mécanisme important par lequel les cellules deviennent résistantes à la thérapie.
La structure de liaison N-éthylène des eAmSPC joue un rôle essentiel dans la manière dont les composés évitent les efflux, ce qui suggère que des liaisons plus longues modifient la manière dont le composé est pompé hors de la cellule. Cela déplace finalement l'équilibre vers des concentrations plus élevées d'eAmSPC dans la cellule et améliore ainsi l'efficacité antimicrobienne.
"Au cours des deux dernières décennies, nous avons constaté une augmentation massive du nombre d'infections causées par des mycobactéries non tuberculeuses comme Mab", a déclaré le co-premier auteur Gregory Phelps, PharmD, St. Jude Graduate School of Biomedical Sciences. "Nous avions un point de départ avec cet antibiotique d'origine naturelle, que, grâce à des modifications, nous avons rendu beaucoup plus efficace contre cet agent pathogène cliniquement pertinent."
Les chercheurs ont également découvert que les eAmSPC fonctionnent bien avec diverses classes d'antibiotiques utilisés pour traiter Mab et conservent leur activité contre d'autres souches mycobactériennes. Ce travail démontre que les eAmSPC devraient être étudiés et développés davantage, car une fois les problèmes de tolérabilité et de sécurité résolus, ces composés pourraient devenir des produits thérapeutiques de nouvelle génération.
"Il est difficile d'inciter les sociétés pharmaceutiques à développer de nouveaux antibiotiques pour plusieurs raisons économiques", a déclaré Phelps. "Si nous pouvons renforcer le pipeline de médicaments contre cette bactérie difficile à traiter, nous pouvons potentiellement faire une différence pour les patients comme ceux que nous avons ici à St. Jude, qui sont de plus en plus confrontés à des options thérapeutiques limitées, voire inexistantes."
Plus d'informations : Gregory A. Phelps et al, Développement de spectinomycines aminométhyliques de 2e génération qui surmontent l'efflux natif chez Mycobacterium abscessus, Actes de l'Académie nationale des sciences (2024). DOI :10.1073/pnas.2314101120
Informations sur le journal : Actes de l'Académie nationale des sciences
Fourni par l'hôpital de recherche pour enfants St. Jude