Des chercheurs de l'Université métropolitaine de Tokyo ont conçu un nouveau système d'analyse micro-totale qui quantifie un produit chimique cible dans une puce microfluidique sans pompes, tubes et détecteurs coûteux. Le composé réagit avec d'autres produits chimiques pour produire un gaz, poussant l'encre dans une chambre connectée le long d'un canal. Les détecteurs de lumière intégrés aident à mesurer la vitesse d'écoulement, permettant ainsi de mesurer le produit chimique d'origine. La portabilité du nouvel appareil permet une analyse clinique quantitative au chevet du patient.
La microfluidique est une technologie révolutionnaire permettant une chimie de précision utilisant beaucoup moins de produits chimiques. En gravant des canaux et des chambres minces dans une puce compacte qui peut tenir dans la paume de votre main, la chimie peut être réalisée avec des quantités de microlitres de liquide dans un ensemble largement parallélisé de conditions de réaction, ce qui permet d'économiser du temps, des coûts et de préserver l'environnement.
Plus récemment, la détection quantitative de produits chimiques a également été intégrée à ces appareils miniatures. Ces systèmes d'analyse micro totale (micro-TAS) promettent une analyse chimique complète qui exploite tous les avantages de la microfluidique.
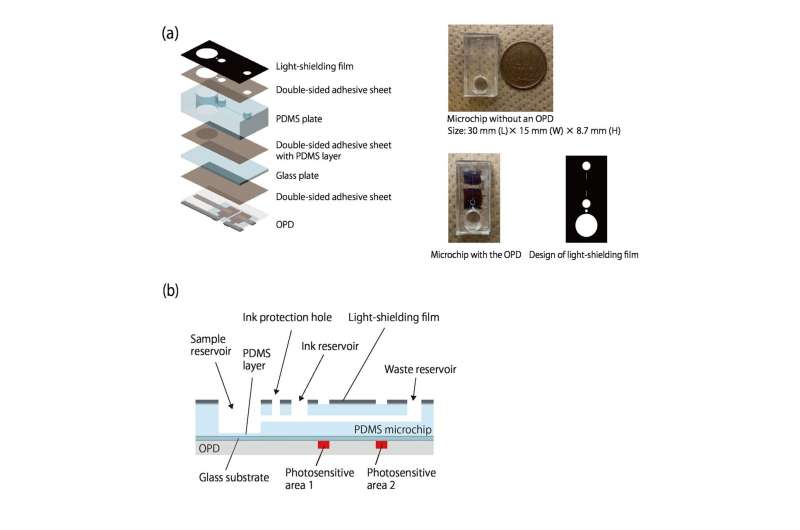
Cependant, pour diriger le flux autour des canaux et des chambres, la microfluidique nécessite des pompes, des tubes pour coupler le flux dans les canaux, ainsi que des sources de lumière et des détecteurs coûteux pour mesurer directement les signaux optiques qui nous indiquent la quantité de différents produits chimiques présents dans nos canaux. Cela rend une méthode basée sur la miniaturisation et la portabilité beaucoup moins maniable que celle initialement proposée.
Mais maintenant, une équipe dirigée par le professeur agrégé Hizuru Nakajima de l’Université métropolitaine de Tokyo a mis au point une toute nouvelle méthode de quantification qui peut éliminer complètement le matériel supplémentaire. L'étude est publiée dans la revue Microchimica Acta .
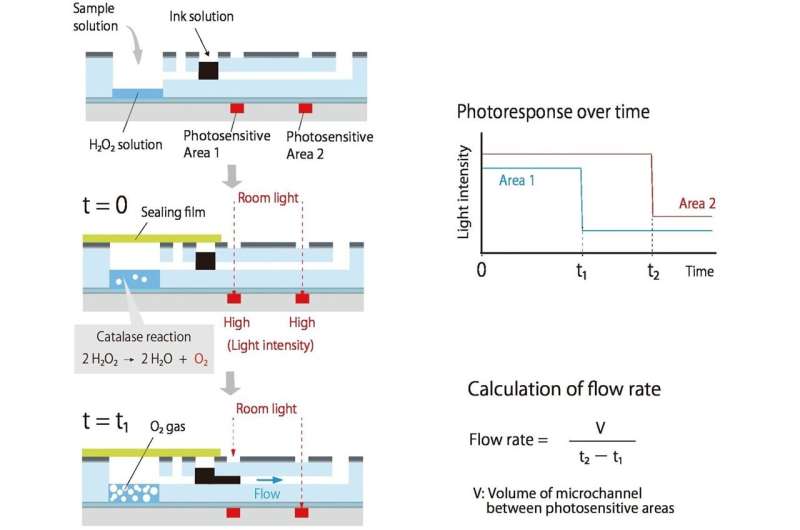
Ils ont mis au point un système dans lequel un composé intéressant (analyte) produit un gaz ; plus il y a d’analyte, plus le gaz est produit rapidement. Cette surpression aide à faire circuler l'encre le long d'un canal connecté.
Au fur et à mesure que l'encre s'écoule, elle bloque la lumière ambiante qui atteint deux photodétecteurs organiques (OPD) imprimés le long du canal, aidant ainsi à mesurer la vitesse d'écoulement. Puisque la lumière doit seulement être bloquée par une encre foncée, la détection requise est simple et peu coûteuse. Puisque le débit est déterminé par la production de gaz, il n'y a ni pompes ni tubes.
Ils ont démontré leur système en mesurant la quantité de protéine C-réactive (CRP), une protéine associée à une réponse du système immunitaire.
Tout d’abord, une solution contenant de la CRP est ajoutée dans une petite chambre ; plus il y a de CRP, plus il s'attache aux parois spécialement traitées de la chambre. Des nanoparticules recouvertes d'anticorps CRP et de catalase sont ensuite ajoutées ; plus il y a de CRP, plus il reste de nanoparticules et de catalase sur les parois. Lorsque du peroxyde d'hydrogène est ajouté, la catalase aide à produire de l'oxygène, bouclant ainsi la boucle entre l'analyte (dans ce cas, la CRP) et le flux d'encre.
L'équipe a démontré que la concentration de CRP dans le sérum humain pouvait être détectée avec précision, même en présence de protéines courantes comme l'immunoglobuline G (IgG) et l'albumine sérique humaine.
Il y avait également un bon accord avec les méthodes couramment disponibles, beaucoup plus gourmandes en matériel. Étant donné que la nouvelle puce de l'équipe est facilement portable, ils pensent qu'elle verra davantage d'applications du micro-TAS dans le diagnostic clinique au chevet du patient ou dans l'analyse environnementale sur le terrain.
Plus d'informations : Kuizhi Qu et al, Développement d'une méthode de quantification de la protéine C-réactive basée sur la mesure du débit d'une solution d'encre expulsée par l'oxygène gazeux généré par la réaction catalase, Microchimica Acta (2023). DOI :10.1007/s00604-023-06108-z
Fourni par l'Université métropolitaine de Tokyo