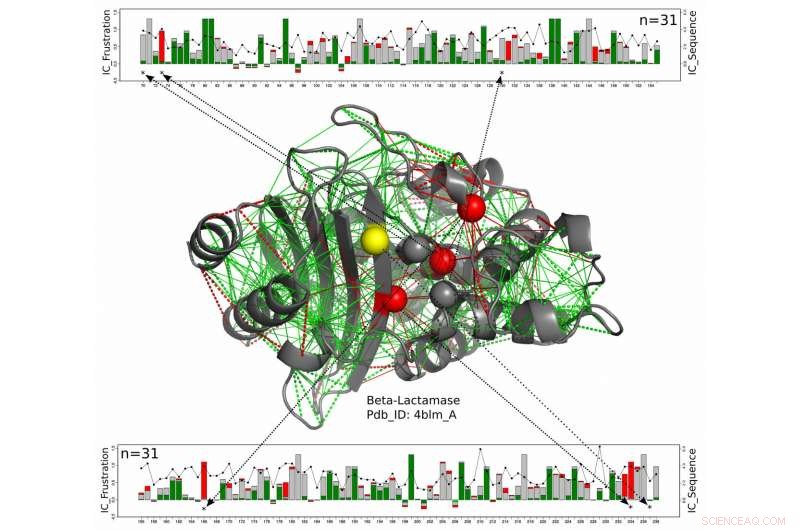
Dans ce modèle structurel pour une protéine bêta-lactamase, les résidus catalytiques sont représentés sous forme de sphères avec ceux qui sont systématiquement fortement frustrés le long de toute la famille des bêta-lactamases représentés en rouge et ceux pour lesquels l'état frustré n'est pas conservé en jaune. Les nouveaux travaux des scientifiques de l'Université Rice, l'Université de Buenos Aires et le Laboratoire européen de biologie moléculaire proposent ces enzymes, qui doivent rester exposés pour réagir avec leurs cibles, obtenir une mesure de protection contre les acides aminés quelque peu frustrés qui les entourent. Les lignes vertes représentent une frustration minimale, les lignes rouges représentent une grande frustration. Les graphiques linéaires en haut et en bas montrent les positions des acides aminés pertinents sur la chaîne protéique et une mesure de la conservation de l'énergie sur l'ensemble de la famille des protéines bêta-lactamases. Crédit :Maria Feiberger/Université de Buenos Aires
Les protéines se replient selon un script écrit dans le modèle de leurs acides aminés. Mais pour fonctionner correctement, certaines parties doivent ad-lib.
Les sites actifs des enzymes, des protéines qui accélèrent et guident les réactions biochimiques, rendre la vie possible. Pour faire ça, leurs instructions doivent entrer en conflit quelque peu avec le plan structurel global de la protéine, selon les scientifiques de l'Université Rice, l'Université de Buenos Aires et le Laboratoire européen de biologie moléculaire à Heidelberg, Allemagne.
Selon les chercheurs, l'évolution a sélectionné des parties d'enzymes comme étant suffisamment importantes pour être autorisées à s'écarter énergétiquement des instructions qui conduisent à un entonnoir pliant, qui guide les protéines dans leurs états fonctionnels de basse énergie. En étudiant essentiellement toutes les enzymes connues, les chercheurs ont également confirmé le soupçon que des niveaux supplémentaires d'interactions plus faiblement frustrées entourent et soutiennent les sites catalytiques eux-mêmes.
La théorie détaillée dans les Actes de la National Academy of Sciences étend le principe accepté de frustration minimale qui explique pourquoi les protéines peuvent progresser en douceur des séquences linéaires initialement codées dans leur ADN à leur fonctionnement, formes globulaires tridimensionnelles. Ce principe reconnaît le fait que la frustration n'est souvent pas résolue lorsque le conflit énergétique restant sert d'une manière ou d'une autre la fonction de la protéine.
Selon Peter Wolynes de Rice, qui a énoncé le principe sous forme mathématique il y a plus de 20 ans, les paysages énergétiques des protéines avec des parties catalytiques méritent une analyse supplémentaire, compte tenu de l'importance que l'évolution leur a attribuée.
"Une molécule parfaitement repliée, peu importe la beauté d'une sculpture, ne peut pas faire grand chose, " dit-il. " Vous devez avoir une protéine qui, tout en étant en grande partie plié, possède encore quelques charnières frustrées incompatibles avec le pliage mais nécessaires pour permettre le mouvement nécessaire aux réactions chimiques."
La frustration au niveau atomique est simple à ressentir :il suffit de pousser les pôles positifs de deux aimants ensemble et de sentir comment ils repoussent. Comme des aimants, les acides aminés d'une protéine repliée s'attirent et se repoussent alors qu'ils résolvent (principalement) les conflits et finissent par former un arrangement stable de contacts.
"Ajoutez maintenant un troisième aimant, et vous pouvez rencontrer une frustration dont vous ne pouvez pas vous débarrasser, " a déclaré le co-auteur Wolynes, qui a travaillé avec l'équipe de Buenos Aires dirigée par le chimiste biologique Diego Ferreiro, un ancien chercheur postdoctoral dans son groupe.
La nouvelle étude montre que la frustration parmi les acides aminés voisins de l'enzyme, comme dans la situation avec le troisième aimant, agit pour aider l'enzyme frustrée à tenir bon. Il reste quelque peu instable mais possède des régions disponibles pour se lier aux molécules cibles et les modifier.
Clairement, Wolyne a dit, l'évolution a des priorités qui remplacent l'esthétique de la réalisation d'un pli parfait.
L'équipe de recherche a étudié informatiquement des centaines de structures protéiques connues et a découvert que des familles entières d'enzymes partagent des signatures caractéristiques de frustration de site actif qui s'étendent aux deuxième et troisième couches d'acides aminés, ou des coquillages, autour de l'enzyme.
"La chose intéressante que nous avons trouvée, c'est que la frustration s'étend généralement au-delà de la première coquille absolue, " a-t-il dit. " Cela signifie qu'il y a une subtilité gênante mais nécessaire dans les contraintes fonctionnelles qui nécessitent de bien utiliser ces trois coques. "
Wolynes a noté que la lauréate du prix Nobel Frances Arnold et d'autres qui étudient l'évolution artificielle en laboratoire ont constaté des preuves de frustration prolongée dans leurs efforts pour modifier les enzymes pour de nouvelles réactions.
"Parfois, ils modifiaient spécifiquement le site actif afin de catalyser des réactions chimiques différentes des réactions naturelles, mais a constaté que les acides aminés éloignés du site actif devaient également changer pour que l'enzyme fonctionne efficacement, " dit-il. " Ce n'était pas évident pourquoi, mais les modèles montrent que les changements dans les deuxième et troisième coquilles améliorent la capacité catalytique des enzymes.
"Donc, nos résultats n'ont pas été un choc complet, mais il est agréable de voir que la frustration prolongée est assez répandue dans la nature et est un thème commun à toutes les classes d'enzymes connues, " il a dit.