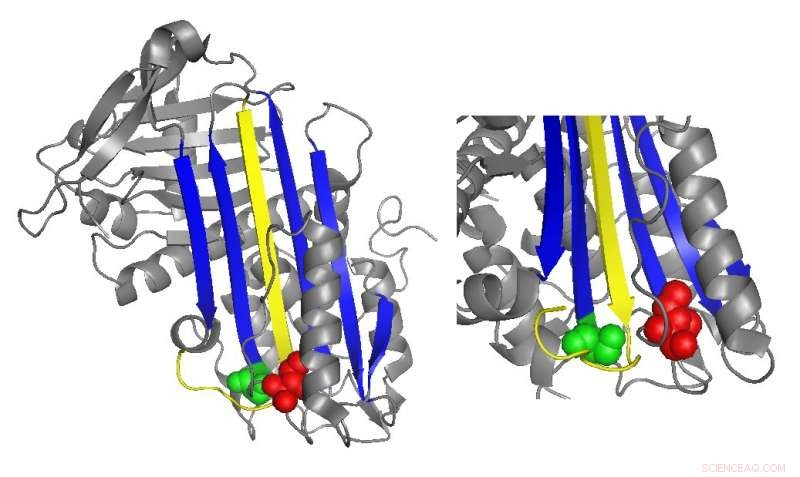
Un diagramme en ruban de l'antithrombine met en évidence les emplacements des mutations fonctionnellement importantes. Crédit :Irène Martinez-Martinez
Lorsqu'une personne est blessée, la coagulation du sang est essentielle. Cependant, une fois le danger passé, il est également essentiel d'arrêter la réponse de la coagulation afin de prévenir la thrombose, ou l'obstruction du flux sanguin par des caillots. Une protéine appelée antithrombine est responsable de l'arrêt de la coagulation, mais environ une personne sur deux mille a un déficit héréditaire en antithrombine qui les expose à un risque beaucoup plus élevé de caillots sanguins potentiellement mortels.
Un groupe de chercheurs en Espagne a analysé les mutations des protéines antithrombine de ces patients et découvert qu'une partie de la protéine joue un rôle inattendu dans sa fonction. Cette compréhension du fonctionnement de l'antithrombine pourrait conduire à des traitements non seulement pour les patients présentant un déficit en antithrombine, mais aussi à des médicaments mieux conçus pour d'autres troubles sanguins. La recherche sera publiée dans le numéro du 6 octobre du Journal de chimie biologique .
Le Centro Regional de Hemodonacion et Hospital Universitario Morales Meseguer de l'Universidad de Murcia en Espagne est un centre de référence pour le diagnostic du déficit en antithrombine. Depuis plus de 15 ans, les chercheurs du laboratoire ont reçu des échantillons de patients présentant diverses mutations qui affectent le fonctionnement de leur antithrombine.
L'antithrombine inhibe normalement la thrombine en insérant une région en forme de boucle, appelée boucle centrale réactive, dans le site actif de la protéine thrombine, empêcher la thrombine de catalyser la formation de caillots en déformant la forme du site actif de la thrombine. De nombreuses mutations de l'antithrombine qui provoquent des maladies de la coagulation affectent directement ou indirectement la boucle centrale réactive. Cependant, des études biochimiques menées par Irene Martinez-Martinez ont découvert que des mutations dans une partie complètement différente de l'antithrombine contribuaient également à son dysfonctionnement.
"Nous avons vu que nous [avions] des mutants qui affectaient la fonction de la protéine même s'ils étaient très éloignés de la partie principale de la protéine qui est en charge de l'inhibition, " Martinez-Martinez a déclaré. "Les gens pensaient que la fonction antithrombine était principalement concentrée sur un domaine de la protéine. Avec ce travail, nous avons réalisé que ce n'est pas vrai."
Les analyses des chercheurs sur les nouvelles mutations ont suggéré que le domaine de l'antithrombine à l'extrémité opposée de la boucle centrale réactive aide à garder la thrombine piégée dans sa phase finale, forme déformée. Lorsqu'il y avait des mutations spécifiques dans cette région, la thrombine était plus souvent capable de revenir à sa forme active et de dégrader et de libérer l'antithrombine.
Martinez-Martinez espère que la compréhension de l'importance de cette région de l'antithrombine pourrait conduire à de meilleurs médicaments pour prévenir la coagulation du sang en activant l'antithrombine ou en prévenant les saignements en l'inhibant. Elle souligne également que la nature essentielle de ce domaine de la protéine n'aurait pas pu être prédite en étudiant simplement les séquences d'antithrombines saines.
« Ce travail a été possible grâce à la caractérisation des mutations identifiées chez les patients, ", a déclaré Martinez-Martinez.
Le travail a été financé par les fondations Instituto de Salud Carlos III et FEDER ainsi que Fundación Séneca.