Crédit :Wiley
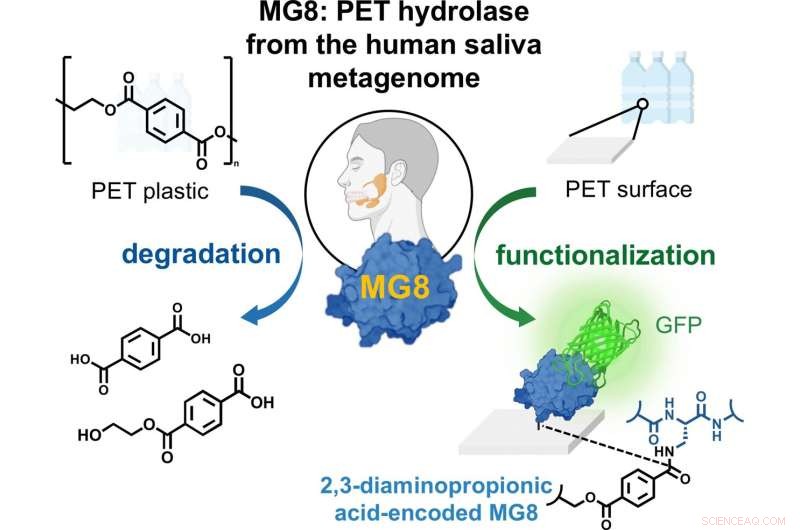
La salive humaine peut contenir une enzyme qui peut décomposer le plastique polyéthylène téréphtalate (PET). Les chercheurs ont trouvé l'enzyme prometteuse, une hydrolase, dans une base de données contenant des échantillons de métagénome humain. Comme ils le rapportent dans la revue Angewandte Chemie International Edition , cette hydrolase nouvellement découverte est plus performante que de nombreuses autres hydrolases PET bactériennes connues. Il peut être produit à l'aide de méthodes biotechnologiques et pourrait être utilisé dans le recyclage du plastique ou pour fonctionnaliser les plastiques, ajoutent les auteurs.
Les sites d'enfouissement et les ports sont connus pour être des sites particulièrement prometteurs pour trouver des bactéries qui se sont adaptées pour consommer ou utiliser des plastiques. Ces bactéries ont développé des enzymes, connues sous le nom d'hydrolases de PET, qui peuvent décomposer le PET en molécules plus petites. Chayasith Uttamapinant du Vidyasirimedhi Institute of Science and Technology (VISTEC) à Rayong, Thaïlande, et Worawan Bhanthumnavin de l'Université Chulalongkorn, Bangkok, Thaïlande, et leurs collègues, ont maintenant découvert la première enzyme à décomposer le PET à partir d'une source un peu plus surprenante :le génome des communautés microbiennes dans la salive humaine.
Les chercheurs pensent que, parce que les humains consomment de grandes quantités d'aliments emballés à l'aide de PET, les microbes de la salive ou du tractus gastro-intestinal peuvent avoir évolué pour digérer les microplastiques. L'équipe a découvert la nouvelle hydrolase, qu'elle a nommée MG8, lors d'une recherche dans une base de données publique de métagénomes contenant des échantillons d'eau de mer et de salive humaine, et a pu attribuer la source probable de l'enzyme à des bactéries Gram-négatives pouvant résider dans la salive humaine. Ces bactéries sont similaires aux souches trouvées près du "Vortex des déchets du Pacifique", qui ont également évolué pour produire des hydrolases PET.
Ils avaient d'abord besoin de suffisamment de matériel pour réaliser leurs expériences, et ils ont donc modifié une bactérie qui peut être cultivée en laboratoire pour produire l'enzyme. Ils ont facilement récupéré une forme active de l'enzyme, capable de décomposer le PET, à partir d'une forme dénaturée pouvant être isolée en grande quantité. Les chercheurs soulignent que cela est très prometteur pour une mise à l'échelle à l'avenir.
Outre les perspectives d'évolutivité du recyclage, l'équipe prévoit également une autre utilisation de MG8. Ils ont découvert que non seulement il peut facilement décomposer le PET mais, avec une petite modification, il peut également s'y lier très efficacement. Pour y parvenir, ils ont modifié la séquence protéique en remplaçant l'un des acides aminés naturels (sérine) au niveau du site actif par un acide aminé non naturel, le DAP. L'enzyme modifiée a immédiatement adhéré à la poudre de PET. Cela pourrait être utilisé comme véhicule pour fonctionnaliser les surfaces en PET, en augmentant la polyvalence du PET dans les dispositifs médicaux, par exemple, et en améliorant la polyvalence du PET recyclé.
Malgré la promesse de MG8 dans le recyclage et la fonctionnalisation du plastique, l'équipe reconnaît que MG8, comme les autres hydrolases PET, a encore besoin de travail. Pour le moment, les plastiques PET de qualité grand public à haute cristallinité ne peuvent pas être décomposés à l'aide de cette hydrolase. Par conséquent, des recherches supplémentaires seront nécessaires pour atteindre le stade où une bouteille d'eau en plastique entière peut être dissoute dans une solution simple contenant l'enzyme. L'enzyme décompose le plastique PET en un temps record