Résumé graphique. Crédit :DOI :10.1038/s41589-021-00841-3
La cholécystokinine (CCK) et la gastrine sont les premières hormones gastro-intestinales découvertes. Ce sont les peptides les plus abondants dans le tractus gastro-intestinal et le système nerveux central, agissant comme des hormones et des neurotransmetteurs physiologiquement importants par le biais de deux sous-types de récepteurs CCK, CCKAR et CCKBR.
Ces deux récepteurs participent à des actions physiologiques fondamentales telles que la régulation de la satiété, sécrétion d'enzymes pancréatiques, et la contraction de la vésicule biliaire. Ils sont également impliqués dans les processus comportementaux, y compris l'anxiété, Mémoire, et la toxicomanie. Cependant, le développement de médicaments contre les récepteurs de la cholécystokinine (CCKR) est un défi principalement en raison du manque d'informations structurelles précises.
Dans deux études, toutes deux publiées dans Nature Chimie Biologie , l'équipe de recherche dirigée par Jiang Yi, Wang Mingwei, H. Eric Xu, Zhao Qiang, et Wu Beili du Shanghai Institute of Materia Medica de l'Académie chinoise des sciences et de l'équipe de recherche dirigée par Zhao Suwen de l'Université de ShanghaiTech, ensemble ont révélé les mécanismes de reconnaissance des ligands, l'activation et la spécificité de couplage des protéines G des CCKR.
Les chercheurs ont d'abord résolu trois structures cristallines du CCKAR humain en complexe avec deux antagonistes de petites molécules (lintitript et dévazépide) et un agoniste complet NN9056, ainsi que cinq structures de cryomicroscopie électronique (cryo-EM) de CCKAR activé par CCK-8 en complexe avec trois protéines G (Gi, Gs, et Gq) et CCKBR activé par la gastrine couplé à deux protéines G (Gi et Gq). Ils ont élucidé les mécanismes de reconnaissance des CCKR par les ligands, activation des CCKR, et la promiscuité des protéines G du CCKAR, qui fournissent toutes des informations fondamentales pour la découverte de médicaments de CCKR.
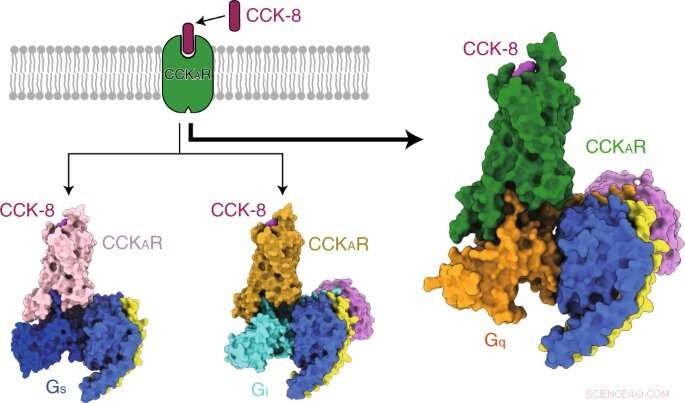
Les chercheurs ont ensuite présenté les structures du CCKAR sulfaté lié au CCK-8 en complexe avec Gq, Gs, et les hétérotrimères Gi à des résolutions globales de 2,9 angströms, 3,1 angströms, et 3,2 angströms, respectivement. Ils ont découvert le mode de liaison du peptide endogène CCK-8, et a constaté que la sulfo-tyrosine dans CCK-8 était cruciale pour une affinité élevée du peptide endogène pour CCKAR.
Régulièrement, les chercheurs ont découvert que la protéine Gq présentait l'activité de couplage la plus puissante du CCKAR. Ces résultats ont confirmé que Gq était le transducteur prédominant du CCKAR et ont souligné l'importance de la zone d'interface dans la sélectivité de couplage des protéines G.
De plus, les chercheurs ont signalé trois structures cristallines de CCKAR liées à de petits antagonistes moléculaires et à un agoniste peptidique, ainsi que deux structures cryo-EM de complexes CCKBR couplés à Gi et Gq. Ils ont révélé le mode de liaison des CCKR par les ligands peptidiques et à petites molécules, et identifié des rôles pivots dans la reconnaissance du CCKAR par le dévazépide et le lintitript, fournissant ainsi un modèle pour la conception de médicaments ciblant les CCKR.
Combinant les structures inactives et actives du CCKAR avec l'analyse de simulation moléculaire, les chercheurs ont proposé le processus d'activation par étapes du CCKAR.
Les résultats de ces deux études ont offert un premier aperçu de la reconnaissance des ligands et de l'activation des deux récepteurs CCK et ont fourni une nouvelle opportunité pour la conception de médicaments ciblant les CCKR.