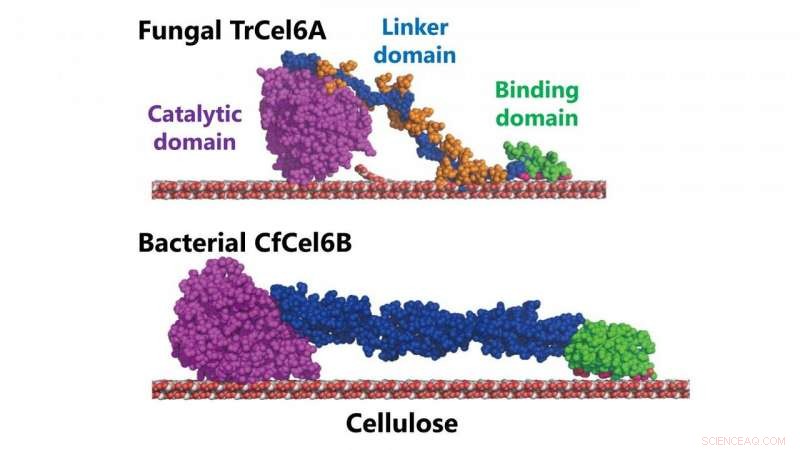
Modèles structuraux de cellobiohydrolases fongiques et bactériennes (TrCel6A, CfCel6B) Crédit :NINS/IMS
Les efforts pour trouver des moyens de décomposer la cellulose - la substance dure qui compose les parois cellulaires des plantes - plus rapidement et de manière plus productive est depuis longtemps un objectif des chercheurs industriels.
Lorsque les plantes sont transformées en biocarburants ou autres applications de biomasse, la cellulose doit d'abord être dégradée en molécules de sucre plus simples, et cette étape peut représenter jusqu'à un quart des coûts d'exploitation et d'investissement de la production de biocarburants. Si ce processus peut être rendu plus rapide et plus productif, cela ne fera pas seulement économiser de l'argent à l'industrie, mais de telles efficacités pourraient également réduire l'impact environnemental de la production.
Les molécules de cellulose se lient très fortement les unes aux autres, rendant la cellulose très difficile à décomposer. Certains champignons sont capables de le décomposer, cependant, et leurs systèmes de dégradation de la cellulose sont bien connus.
Les champignons produisent de nombreux types de cellulases — des enzymes qui accélèrent la réaction chimique qui dégrade la cellulose. Et ces champignons ont été largement utilisés dans l'industrie pour cette raison. Par exemple, le champignon Trichoderma reesei — découvert pendant la Seconde Guerre mondiale dans le Pacifique à la suite de sa consommation de tentes et de vêtements — est utilisé dans la production de jeans délavés à la pierre. Cellobiohydrolase , un type de cellulase que le champignon produit, décompose la cellulose en cellobiose, un sucre simple plus facilement utilisable par les organismes. Cela dégrade légèrement la matière denim par endroits, ce qui à son tour l'assouplit - le faisant apparaître comme lavé avec des pierres - et le rend plus confortable à porter.
Mais il existe un autre type de système de dégradation de la cellulose utilisé par certaines bactéries, et qui est similaire à bien des égards à celui utilisé par ce champignon. Mais ce système n'a pas été très bien compris jusqu'à présent. Dans un journal du Journal de chimie biologique le 18 août, chercheurs de l'Institut japonais des sciences moléculaires, Instituts nationaux des sciences naturelles (IMS, NINS) ont finalement décrit ce système en détail au niveau d'une molécule unique.
Le type de cellobiohydrolase produite par la bactérie Cellulomonas fimi possède un domaine catalytique similaire à la cellobiohydrolase produite par T. reesei . Le domaine catalytique d'une enzyme est sa région qui interagit avec une molécule qu'elle veut modifier ou décomposer (afin de provoquer la réaction enzymatique). Le champignon et le système de dégradation de la cellulose de la bactérie présentent également une activité hydrolytique similaire (la façon dont ils utilisent l'eau pour briser les liaisons chimiques de la cellulose).
Mais les deux systèmes ont des modules de liaison aux glucides différents (la série de protéines de l'enzyme qui se lient aux glucides de la cellulose) et ce qu'on appelle des "linkers", essentiellement la partie de l'enzyme qui relie le domaine catalytique aux modules de liaison aux glucides.
Dans des recherches antérieures, les scientifiques du NINS avaient déjà établi que la structure de la région de liaison de la cellobiohydrolase fongique jouait un rôle crucial dans la vitesse à laquelle l'enzyme se lie à la cellulose (et donc à quelle vitesse le système dégrade la cellulose).
« Donc, les prochaines questions évidentes étaient :même si ces autres parties de la cellobiohydrolase de la bactérie sont différentes de celles du champignon, font-ils néanmoins quelque chose de similaire ?" ont déclaré Akihiko Nakamura et Ryota Iino, les chercheurs de l'équipe. « Est-ce qu'ils accélèrent également la dégradation de la cellulose ? »
Ils ont constaté qu'ils le font. Les scientifiques ont utilisé l'imagerie par fluorescence à molécule unique - une méthode de microscopie avancée qui fournit des images de cellules vivantes avec une résolution de seulement quelques dizaines de nanomètres - pour observer la cellobiohydrolase de la bactérie se liant et se dissociant des molécules de cellulose.
Cela leur a permis de clarifier les fonctions des différentes parties du système de dégradation de la cellulose. Ils ont découvert que les modules de liaison aux glucides étaient en effet importants pour la liaison initiale, mais le rôle joué par la région de liaison était assez mineur.
Cependant, ils ont constaté que le domaine catalytique n'était pas si similaire après tout. Sa structure montrait des boucles plus longues à l'entrée et à la sortie d'un "tunnel" au cœur du système par rapport à celle du champignon. Et cette différence dans la structure du tunnel se traduit par une processivité plus élevée - la capacité d'une enzyme à déclencher plusieurs réactions consécutives.
Les prochaines étapes consisteront à concevoir ces enzymes bactériennes de dégradation de la cellulose pour décomposer la cellulose plus rapidement.