Crédit :Wiley
A partir des produits chimiques disponibles, une équipe de chercheurs allemands a achevé avec succès la synthèse totale d'agarozizanol B, une substance naturelle intéressante trouvée dans le bois d'agar. Comme décrit dans le journal Angewandte Chemie , la séquence clé de la voie de synthèse relativement courte est une cascade de réactions photochimiques qui implique une série de réarrangements complexes d'intermédiaires polycycliques.
Les terpènes sont des substances naturelles qui proviennent principalement des plantes et ont une grande diversité structurelle. Officiellement, ils sont constitués d'unités isoprène (2-méthylbuta-1, 3-diène). sesquiterpènes, des terpènes constitués de trois unités isoprènes, sont le sous-ensemble le plus grand et le plus important. Leur charpente de base est constituée de 15 atomes de carbone qui peuvent être agencés de manières très différentes, généralement dans des systèmes de plusieurs anneaux d'atomes de carbone. Certains sesquiterpènes polycycliques sont utilisés comme composés odorants et aromatisants, ainsi que des agents pharmaceutiques.
Une famille de sesquiterpènes ayant une activité antidiabétique et un degré élevé de complexité structurelle a récemment été isolée du bois d'agar (également connu sous le nom de bois d'aigle) et de plusieurs autres plantes. Ils partagent tous un cadre central commun connu sous le nom de squelette prezizane. Dirigé par Thorsten Bach à l'Université technique de Munich (Allemagne), une équipe a maintenant achevé la synthèse totale d'un membre de cette famille de produits naturels, agarozizanol B. Une synthèse totale est la formation complète d'un produit naturel de base, matières premières disponibles.
Le squelette prezizane est un système de trois cycles d'atomes de carbone :un cycle à six chaînons qui est attaché à un cycle à cinq chaînons le long d'un bord et est également ponté par deux autres atomes de carbone pour former un deuxième cycle à cinq chaînons. Le défi de la synthèse d'une telle structure est que le squelette peut exister sous deux formes d'image miroir (désignées comme les formes (+) et (-)). L'agarozizanol B possède également deux groupes latéraux qui doivent également avoir la bonne orientation spatiale.
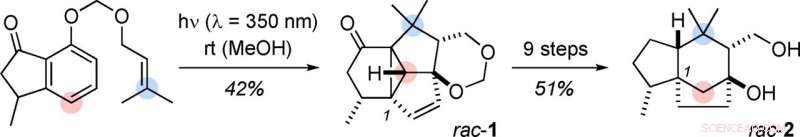
Le point de départ de cette séquence réactionnelle en onze étapes - qui est très courte pour une synthèse totale - est un dérivé de l'indanone. Ce composé contient déjà un système avec un cycle à cinq chaînons et un cycle à six chaînons, bien qu'aromatique. Les atomes de carbone manquants sont attachés à l'indanone sous la forme d'une chaîne latérale d'oléfine. Au cœur de cette synthèse se trouve une cascade photochimique qui comprend trois réactions induites par la lumière et une série de réarrangements complexes d'intermédiaires polycycliques. La première étape produit un cadre tétracyclique tendu qui contient tous les atomes de carbone de l'agarozizanol B dans les positions relatives correctes, avec perte de l'aromaticité indésirable du cycle à six carbones. Plus tard, une conversion conduit au squelette tricyclique prezizane par ouverture d'un cycle à trois carbones dans un intermédiaire (séparation d'une liaison cyclopropane).
"De cette façon, nous avons obtenu un mélange des formes (+) et (-) ainsi que du (+)-agarozizanol B pur, qui est identique au produit naturel, ", déclare Thorsten Bach. "Notre réaction en cascade photochimique récemment développée s'est avérée très prometteuse pour les futures synthèses d'autres produits naturels."