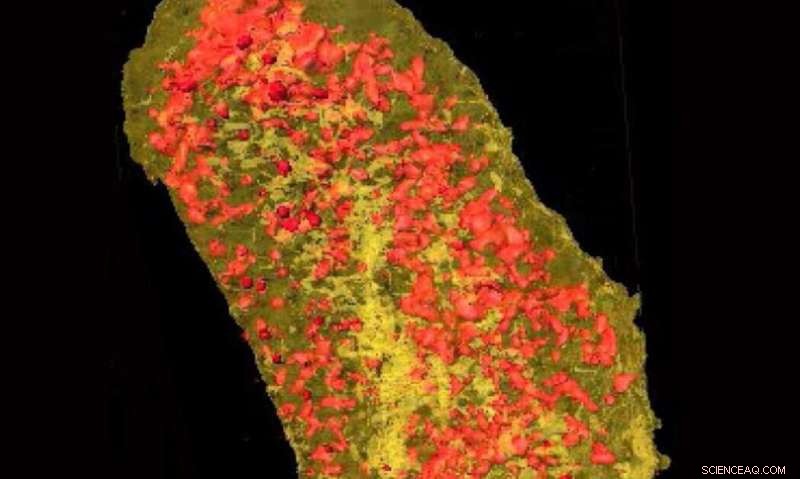
Des radiographies ultrabrillantes ont révélé la concentration d'erbium (jaune) et de zinc (rouge) dans une seule cellule d'E. coli exprimant une étiquette de liaison aux lanthanides et incubée avec de l'erbium. Crédit :Laboratoire national de Brookhaven
Une équipe de scientifiques comprenant des chercheurs de la National Synchrotron Light Source II (NSLS-II) - une installation utilisateur du bureau des sciences du département américain de l'Énergie (DOE) au laboratoire national de Brookhaven du DOE - a démontré une nouvelle technique d'imagerie des protéines en 3D. avec une résolution à l'échelle nanométrique. Leur travail, publié dans le Journal de l'American Chemical Society , permet aux chercheurs d'identifier l'emplacement précis des protéines dans les cellules individuelles, atteindre la résolution de la membrane cellulaire et des plus petits organites subcellulaires.
« Dans le monde de la biologie structurale, les scientifiques utilisent des techniques telles que la cristallographie aux rayons X et la cryomicroscopie électronique pour en savoir plus sur la structure précise des protéines et en déduire leurs fonctions, mais nous n'apprenons pas où ils fonctionnent dans une cellule, " a déclaré l'auteur correspondant et scientifique de la NSLS-II Lisa Miller. " Si vous étudiez une maladie particulière, vous devez savoir si une protéine fonctionne au mauvais endroit ou pas du tout."
La nouvelle technique développée par Miller et ses collègues est similaire dans son style aux méthodes traditionnelles de microscopie à fluorescence en biologie, dans laquelle une molécule appelée protéine fluorescente verte (GFP) peut être attachée à d'autres protéines pour révéler leur emplacement. Lorsque GFP est exposé aux UV ou à la lumière visible, il émet une fluorescence verte brillante, éclairant une protéine autrement "invisible" dans la cellule.
"En utilisant GFP, nous pouvons voir si une protéine se trouve dans des structures subcellulaires de plusieurs centaines de nanomètres, comme le noyau ou le cytoplasme, " Miller a dit, "mais des structures comme une membrane cellulaire, qui ne mesure que sept à 10 nanomètres, sont difficiles à voir avec des balises lumineuses visibles comme GFP. Pour voir des structures de la taille de 10 nanomètres dans une cellule, vous bénéficiez grandement de l'utilisation des rayons X."
Pour surmonter ce défi, des chercheurs du NSLS-II se sont associés à des scientifiques du Massachusetts Institute of Technology (MIT) et de l'Université de Boston (BU) qui ont développé une étiquette sensible aux rayons X appelée étiquette de liaison aux lanthanides (LBT). Les LBT sont de très petites protéines qui peuvent se lier étroitement aux éléments de la série des lanthanides, comme l'erbium et l'europium.
"Contrairement à GFP, qui émet une fluorescence lorsqu'elle est exposée aux UV ou à la lumière visible, les lanthanides sont fluorescents en présence de rayons X, " a déclaré l'auteur principal Tiffany Victor, un associé de recherche à NSLS-II. "Et puisque les lanthanides ne se produisent pas naturellement dans la cellule, quand on les voit au microscope à rayons X, nous connaissons l'emplacement de notre protéine d'intérêt."
Les chercheurs de NSLS-II, MIT, et BU ont collaboré pour combiner la technologie LBT avec la fluorescence X.
« Bien que les LBT aient été largement utilisés au cours de la dernière décennie, ils n'ont jamais été utilisés pour des études de fluorescence X, ", a déclaré Miller.
Des radiographies ultrabrillantes ont révélé la concentration d'erbium (jaune) et de zinc (rouge) dans une seule cellule d'E. coli exprimant une étiquette de liaison aux lanthanides et incubée avec de l'erbium. Crédit :Laboratoire national de Brookhaven
Au-delà de l'obtention d'images à plus haute résolution, La fluorescence X fournit simultanément des images chimiques sur tous les oligo-éléments d'une cellule, comme le calcium, potassium, fer à repasser, le cuivre, et zinc. Dans d'autres études, L'équipe de Miller étudie comment les oligo-éléments comme le cuivre sont liés à la mort des neurones dans des maladies comme la maladie d'Alzheimer. Visualiser l'emplacement de ces éléments par rapport à des protéines spécifiques sera la clé de nouvelles découvertes.
En plus de leur compatibilité avec les rayons X, Les LBT sont également avantageux pour leur taille relativement petite, par rapport aux balises lumineuses visibles.
"Imaginez que vous ayez une queue attachée à vous qui était de la taille de tout votre corps, ou plus grand, " Miller a dit. " Il y aurait beaucoup d'activités normales que vous ne seriez plus en mesure de faire. Mais si tu devais te promener avec une toute petite queue de cochon, tu peux encore courir, saut, et passer par les portes. La GFP est comme la grosse queue - elle peut être un véritable obstacle au fonctionnement de nombreuses protéines. Mais ces petites balises liant les lanthanides sont presque invisibles."
Démontrer l'utilisation des LBT pour l'imagerie des protéines en 3D avec une résolution à l'échelle nanométrique, les chercheurs du MIT et de la BU ont marqué deux protéines dans une cellule bactérienne :une protéine cytoplasmique et une protéine membranaire. Puis, L'équipe de Miller a étudié l'échantillon sur la ligne de lumière de la nanosonde à rayons X durs (HXN) au NSLS-II et la ligne de lumière à la bionanoprobe à l'Advanced Photon Source (APS) - une installation utilisateur du DOE Office of Science au DOE's Argonne National Laboratory.
"HXN offre la taille de mise au point des rayons X la plus performante au monde, qui descend à environ 12 nanomètres. Cela était essentiel pour l'imagerie de la cellule bactérienne en 3D avec une résolution à l'échelle nanométrique, " dit Yong Chu, scientifique en chef des lignes de lumière chez HXN. "Nous avons également développé une nouvelle façon de monter les cellules sur un porte-échantillon spécialisé afin d'optimiser l'efficacité des mesures."
En couplant la résolution inégalée du HXN aux capacités des LBT, l'équipe a pu imager les deux protéines marquées. La visualisation de la protéine de la membrane cellulaire a prouvé que les LBT peuvent être vus à haute résolution, tandis que l'imagerie de la protéine cytoplasmique a montré que les LBT pouvaient également être visualisés dans la cellule.
"A de fortes concentrations, les lanthanides sont toxiques pour les cellules, " Victor dit, "Il était donc important pour nous de montrer que nous pouvions traiter les cellules avec une très faible concentration de lanthanide qui était non toxique et suffisamment importante pour traverser la membrane cellulaire et imager les protéines que nous voulions voir."
Maintenant, avec cette nouvelle technique démontrée avec succès, les scientifiques espèrent pouvoir utiliser les LBT pour imager d'autres protéines dans la cellule à une résolution de 10 nanomètres.