
Crédit :Elena Khavina/MIPT
Des chercheurs de l'Institut de physique et de technologie de Moscou ont publié une revue sur la cristallographie femtoseconde en série, l'une des méthodes les plus prometteuses pour analyser la structure tertiaire des protéines. Cette technique a rapidement évolué au cours de la dernière décennie, ouvrant de nouvelles perspectives pour la conception rationnelle de médicaments ciblant des protéines auparavant inaccessibles à l'analyse structurale. L'article est paru dans le journal Avis d'expert sur la découverte de médicaments .
Cristallographie aux rayons X
La cristallographie aux rayons X est l'une des principales méthodes pour révéler la structure 3-D des macromolécules biologiques, comme les protéines. Il a aidé à déterminer la structure de nombreux récepteurs et enzymes pharmacologiquement importants, permettant la conception de médicaments ciblant ces protéines.
La méthode consiste à cristalliser une protéine et à l'étudier par diffraction des rayons X. Tout d'abord, la protéine est isolée et purifiée. Ensuite, le solvant sèche progressivement. Par conséquent, les molécules dont la structure est étudiée forment des cristaux, caractérisé par un ordre interne. En exposant un cristal aux rayons X dans un appareil spécial, les chercheurs obtiennent un diagramme de diffraction. Il contient des informations sur les positions des atomes dans le cristal. Une analyse approfondie du motif révèle la structure 3-D des molécules protéiques constitutives.
Avant l'avènement de cette méthode, les nouveaux médicaments étaient surtout recherchés de manière empirique :soit en modifiant la structure des molécules connues pour affecter la protéine cible, ou en triant des matrices de molécules dans des bibliothèques chimiques. Maintenant que les structures 3-D de nombreuses protéines cibles sont disponibles, les chercheurs peuvent les visualiser sur un écran d'ordinateur et trier rapidement des millions de composés à la recherche de médicaments candidats. De cette façon, ils économisent beaucoup de temps et d'argent auparavant consacrés à la synthèse chimique et aux expériences "humides".
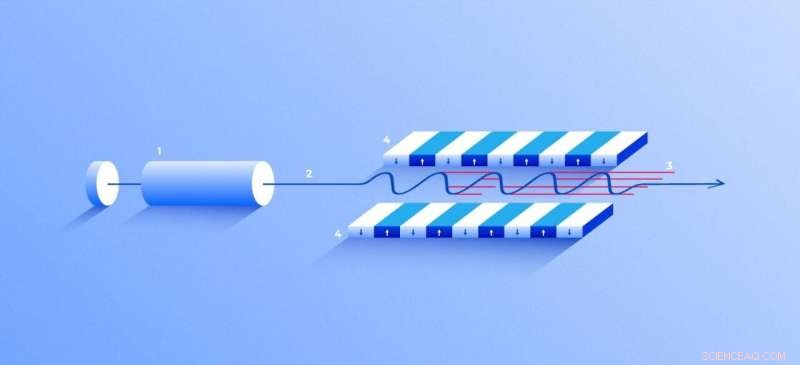
Laser à rayons X à électrons libres. Une source (1) émet des électrons libres (2) se déplaçant simplement des dizaines de fois plus lentement que la vitesse de la lumière à travers l'onduleur (4), un tunnel bordé de nombreux aimants. Le champ magnétique fait osciller un électron traversant le tunnel et donc émettre des rayons X. Le mouvement des électrons dans l'onduleur est synchronisé pour générer serré, impulsions de rayons X à haute fréquence d'une intensité remarquable (3). Crédit :Elena Khavina/MIPT
La cristallographie aux rayons X donne de bons résultats pour les cristaux de grande taille, stable, et homogène, c'est-à-dire sans impuretés ni défauts structurels. Pour mieux détecter un signal de diffraction faible, une puissante impulsion de rayonnement est nécessaire, mais pas assez puissant pour détruire le cristal. En cristallographie aux rayons X classique, un cristal de protéine est tourné dans le faisceau de rayons X pour produire des motifs de diffraction pour diverses orientations spatiales. Cela capture un maximum d'informations sur la structure.
Méthode pour cibles difficiles
Peu de temps après l'émergence de la cristallographie aux rayons X, il est devenu évident que toutes les macromolécules biologiques ne peuvent pas être cristallisées. Certaines protéines sont ordinairement dissoutes dans le milieu cellulaire interne. Il est donc assez facile de les mettre en solution, l'évaporer, et obtenir un gros cristal régulier. Mais les protéines membranaires, de nombreux récepteurs parmi eux, forment des cristaux qui ne sont pas assez gros et purs pour une cristallographie aux rayons X standard. Cela dit, nombre de ces protéines sont impliquées dans le développement de la maladie, ce qui signifie que leur structure est d'un grand intérêt pour les pharmacologues.
Il y a moins d'une décennie, une solution a été trouvée pour les protéines membranaires. Cette nouvelle technique, appelée cristallographie aux rayons X femtoseconde en série, ou SFX, repose sur des lasers à rayons X à électrons libres, développé peu de temps avant SFX.
Alexeï Michine, directeur adjoint du laboratoire de biologie structurale des récepteurs du MIPT, co-auteur de l'étude, a expliqué:"Ce qui en fait une technologie révolutionnaire, c'est une densité d'énergie très élevée de l'impulsion laser. L'objet est exposé à un rayonnement si puissant qu'il se désagrège, inévitablement et presque instantanément. Mais avant cela, certains quanta individuels de l'impulsion laser se dispersent hors de l'échantillon et se retrouvent au niveau du détecteur. C'est le principe dit de diffraction avant destruction pour étudier la structure de la protéine d'origine."

Deux manières d'introduire des cristaux dans la zone de fonctionnement de l'appareil :dans un courant de liquide (3, gauche) et sur un substrat solide (3, droit). Dans les deux cas, le faisceau de rayons X (2) traversant des cristaux génère un diagramme de diffraction sur l'écran (1). Crédit :Elena Khavina/MIPT
Les lasers à rayons X à électrons libres se sont avérés utiles en dehors de la biologie :au cours des dernières années, SFX est de plus en plus utilisé par les physiciens et les chimistes, trop. Le premier appareil est devenu disponible pour les expérimentateurs en 2009, et maintenant il y a cinq centres ouverts aux chercheurs aux États-Unis, Japon, Corée du Sud, Allemagne, et la Suisse. Un nouveau est en construction en Chine, et l'installation américaine, historiquement la première, a annoncé des plans de modernisation.
Alors que la nouvelle technologie a offert aux chercheurs un aperçu de la structure des protéines échappant auparavant à l'analyse, il a également promu de nouvelles solutions techniques et mathématiques. La cristallographie aux rayons X conventionnelle consiste à exposer un cristal à un rayonnement sous différents angles et à analyser collectivement les diagrammes de diffraction résultants. Dans SFX, le cristal est instantanément détruit par la première interaction avec une puissante impulsion de rayons X. Les chercheurs doivent donc répéter le processus avec de nombreux petits cristaux et analyser les données "séries" ainsi générées, d'où le nom de la méthode.
Un autre défi consiste à sélectionner les échantillons pour SFX. En cristallographie aux rayons X classique, choisir simplement le cristal le plus grand et de la plus haute qualité était la voie à suivre. Cela peut être fait manuellement, en regardant les échantillons disponibles. La nouvelle procédure nécessite de travailler avec une suspension de nombreux petits cristaux de taille et de qualité variables. Des centrifugeuses et des filtres avec des dimensions de pores connues sont utilisés pour séparer les cristaux par taille.
Des méthodes de placement des échantillons dans la chambre ont dû être élaborées, trop. Les lasers à rayons X à électrons libres ont une certaine fréquence maximale à laquelle ils peuvent émettre des impulsions de rayonnement. Pour réduire les dépenses et la consommation de temps, de nouveaux cristaux doivent être introduits dans la chambre à la même fréquence. Jusque là, deux approches ont été développées pour ce faire. Sous le premier, les cristaux pénètrent dans la chambre en suspension liquide, alimenté par un injecteur. Le jet quittant l'injecteur est « pressé » par un flux de gaz pour assurer un placement correct de l'échantillon. C'est-à-dire, lors du passage, un cristal se retrouve précisément au centre du faisceau laser (fig. 2, la gauche). Alternativement, les cristaux de protéines peuvent être étalés sur un substrat transparent aux rayons X et automatiquement introduits dans le faisceau laser avant chaque impulsion (fig. 2, droit).
Depuis la production de ses premiers résultats en 2011, SFX a révélé plus de 200 structures protéiques. Parmi elles, 51 cibles potentiellement importantes pour la pharmacologie :les récepteurs membranaires, fermenter, protéines virales, etc—qui étaient autrefois inaccessibles aux techniques analytiques conventionnelles.
L'examen systématique de la technologie appliquée à la biologie et à la pharmacologie par l'équipe MIPT aidera sans aucun doute d'autres chercheurs cherchant à obtenir les structures de cibles médicamenteuses clés pour développer de nouveaux médicaments.