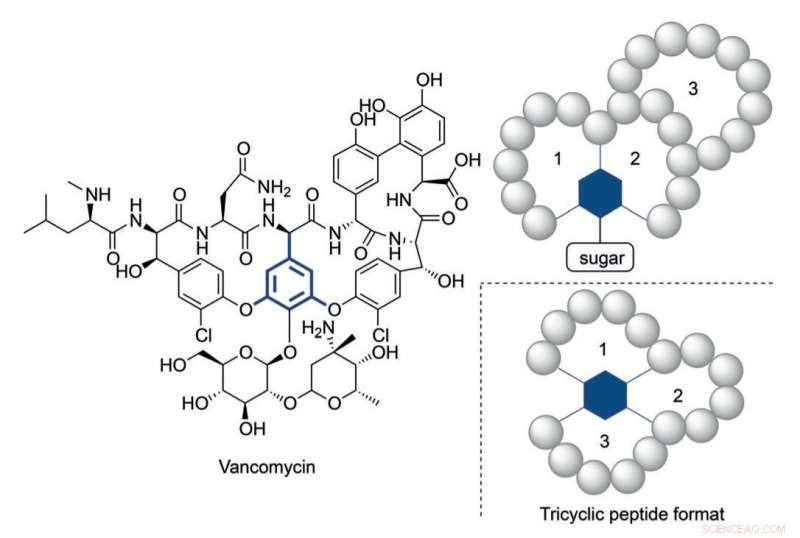
Structure de la vancomycine et un format peptidique tricyclique inspiré de sa structure multicyclique. Crédit :HIMS
Des chimistes de l'Institut Van 't Hoff des sciences moléculaires (HIMS) de l'Université d'Amsterdam et de Pepscan (Lelystad) ont développé une nouvelle méthodologie pour verrouiller des peptides linéaires dans des structures tricycliques hautement rigidifiées à potentiel pharmaceutique. Leurs conclusions viennent d'être rapportées dans Angewandte Chemie .
La méthodologie, développé par HIMS Ph.D. étudiant Gaston Richelle, permet la synthèse parallèle de plusieurs peptides tricycliques dans un format de bibliothèque. Cela permet un criblage biologique ultérieur afin d'identifier de nouvelles thérapies peptidiques.
Niveau de complexité structurelle plus élevé
Au cours de la dernière décennie, les peptides cycliques sont devenus une classe thérapeutique prometteuse, montrant une large fenêtre thérapeutique qui va de l'antifertilité aux applications antivirales et anticancéreuses. De nombreux peptides monocycliques et bicycliques ont été identifiés et le nombre de peptides cycliques entrant dans les essais cliniques a considérablement augmenté.
Toutefois, il est devenu clair que dans certains cas, des peptides plus complexes structurellement sont nécessaires pour atteindre des niveaux d'activité appropriés. Vancomycine, le peptide antibiotique tricyclique "de dernier recours", fournit un exemple illustratif d'une construction aussi complexe. L'augmentation alarmante de la résistance des bactéries contre les antibiotiques actuellement disponibles nécessite des constructions peptidiques complexes par analogie à la vancomycine.
Crédit :HIMS
La recherche de nouvelles voies de synthèse vers des peptides multicycliques complexes a ainsi suscité un vif intérêt. Les méthodologies précédemment rapportées pour créer des peptides multicycliques ont été limitées en raison de la formation d'isomères multiples, des protocoles de réaction laborieux ou une diversité structurelle limitée.
CLIPS combinés avec CuAAC
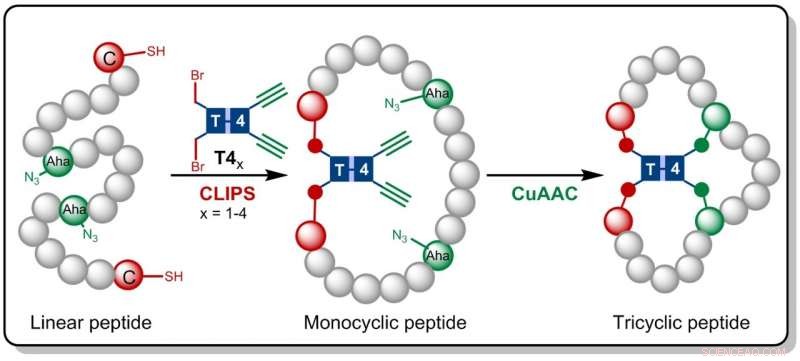
Dans la recherche maintenant publiée dans Angewandte Chemie , les chimistes d'Amsterdam s'appuient sur la technologie CLIPS développée précédemment à Pepscan. Cette méthode de « liaison chimique des peptides sur les échafaudages » produit des peptides monocycliques et bicycliques qui se sont révélés présenter des sélectivités et des affinités améliorées contre les protéines cibles.
Gaston Richelle a maintenant combiné la méthode CLIPS avec la chimie 'click' entièrement compatible CuAAC, conduisant à la formation des peptides tricycliques complexes. En utilisant des molécules d'échafaudage flexibles, les peptides tricycliques recherchés sont formés de façon isomériquement pure. Le principal avantage de la nouvelle méthodologie est que les réactions CLIPS et CuAAC peuvent être effectuées dans une procédure en un seul pot sans limitation de la nature et des quantités d'acides aminés qui sont mis en œuvre dans les boucles peptidiques.
En conséquence, la méthodologie peut être appliquée dans des bibliothèques de peptides à haute diversité pour générer une large gamme de topologies tricycliques qui peuvent être criblées pour l'activité biologique. Actuellement de multiples criblages d'inhibition sont réalisés, par exemple. contre les enzymes qui sont très abondantes dans les cellules cancéreuses de premier stade. De nouvelles études d'activité antimicrobienne sont également menées contre le SARM et Staphylococcus aureus. Ajoutant à cela, l'équipe de recherche étudie actuellement l'utilisation d'échafaudages T6 encore plus complexes pour créer des peptides penta- et hexacycliques.