
L'équipe du pôle d'excellence Resolv a étudié la chimie dans l'espace interstellaire. Crédit : RUB, Lehrstuhl für Astrophysik
Un groupe de recherche de la Ruhr-Universität Bochum a étudié comment les acides interagissent avec les molécules d'eau à des températures extrêmement basses. À l'aide d'analyses spectroscopiques et de simulations informatiques, ils ont étudié la question de savoir si l'acide chlorhydrique (HCl) libère ou non son proton dans des conditions telles que celles trouvées dans l'espace interstellaire. La réponse dépend de l'ordre dans lequel les molécules d'eau et d'acide chlorhydrique se réunissent.
Le groupe dirigé par le professeur Martina Havenith, Chaire de chimie physique II, et le professeur Dominik Marx, Chaire de chimie théorique, de la Ruhr-Universität Bochum, avec l'équipe dirigée par le Dr Britta Redlich de l'Université Radboud, Nimègue, décrit les résultats dans le journal Avancées scientifiques , publié en ligne à l'avance le 7 juin 2019.
Comprendre comment des molécules complexes se sont formées
Si l'acide chlorhydrique entre en contact avec des molécules d'eau dans des conditions normales, comme à température ambiante, l'acide se dissocie immédiatement, libérer son proton (H+); il reste un ion chlorure (Cl-). L'équipe de recherche a voulu savoir si le même processus se déroule également à des températures extrêmement basses inférieures à 10 Kelvin, c'est à dire., en dessous de moins 263,15 degrés Celsius. "Nous aimerions savoir si la même chimie acide-alcali que nous connaissons sur Terre existe également dans les conditions extrêmes de l'espace interstellaire, " explique Martina Havenith, conférencier pour le Pôle d'Excellence Resolv. "Les résultats sont cruciaux pour comprendre comment des molécules chimiques plus complexes se sont formées dans l'espace, bien avant l'apparition des premiers précurseurs de la vie."
Afin de reproduire les températures extrêmement basses en laboratoire, les chercheurs ont mené les réactions chimiques dans une gouttelette d'hélium superfluide. Ils ont surveillé les processus à l'aide d'un type spécial de spectroscopie infrarouge, capable de détecter les vibrations moléculaires à basses fréquences. Les chercheurs ont utilisé un laser avec une luminosité particulièrement élevée à Nimègue pour cela. Des simulations informatiques ont permis aux scientifiques d'interpréter les résultats expérimentaux.
D'abord, les chercheurs ont ajouté quatre molécules d'eau, l'un après l'autre, à la molécule d'acide chlorhydrique. L'acide chlorhydrique dissocié au cours de ce processus, donner son proton à une molécule d'eau, résultant en un ion hydronium. L'ion chlorure restant, l'ion hydronium et les trois autres molécules d'eau formaient un amas.
Cependant, si les chercheurs créaient d'abord un amas glacé à partir des quatre molécules d'eau, puis ajoutaient l'acide chlorhydrique, ils ont donné un résultat différent :la molécule d'acide chlorhydrique ne s'est pas dissociée; le proton reste lié à l'ion chlorure.
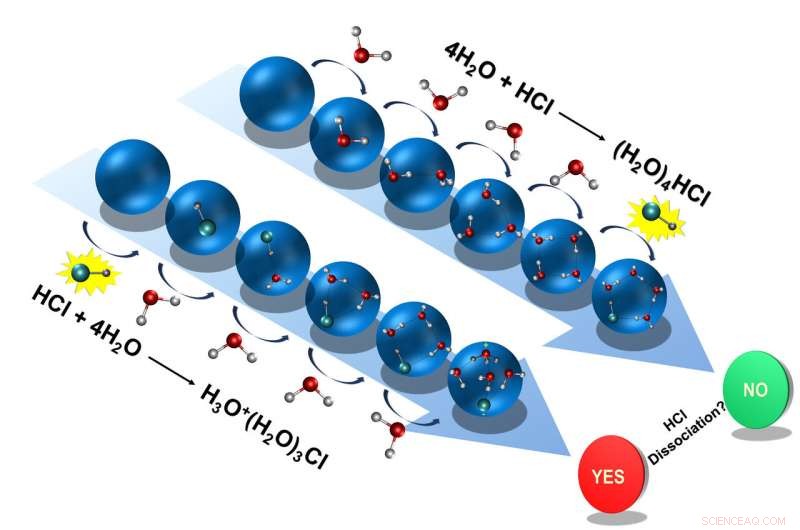
Les deux voies possibles que l'acide muriatique peut suivre dans des conditions comme celles trouvées dans l'espace interstellaire :Dissocier ou absorber dans l'eau glacée. Crédit :D. Mani
"Dans les conditions que l'on peut trouver dans l'espace interstellaire, les acides sont ainsi capables de se dissocier, mais cela ne doit pas nécessairement se produire - les deux processus sont les deux faces d'une même pièce, pour ainsi dire, " dit Martina Havenith.
La chimie dans l'espace n'est pas simple
Les chercheurs ont supposé que le résultat peut également être appliqué à d'autres acides, car il représente le principe de base de la chimie dans des conditions ultrafroides.
"La chimie dans l'espace n'est en aucun cas simple; elle pourrait même être plus complexe que la chimie dans des conditions planétaires, " dit Dominik Marx. Après tout, cela dépend non seulement des rapports de mélange des substances réagissantes mais aussi de l'ordre dans lequel elles sont ajoutées les unes aux autres. "Ce phénomène doit être pris en compte dans les futures expériences et simulations dans des conditions ultrafroides, ", explique le chercheur.