Tendances du tableau périodique. Crédits :Sandbh/Wikipédia, CC BY-SA
La nouvelle a éclaté qu'un wagon de chemin de fer, chargé de sodium pur, venait de dérailler et déversait son contenu. Un journaliste de télévision m'a appelé pour m'expliquer pourquoi les pompiers n'étaient pas autorisés à utiliser de l'eau sur les flammes qui jaillissaient de la voiture mutilée. Pendant que j'étais à l'antenne, j'ai ajouté du sodium à un peu d'eau dans une boîte de Pétri et nous avons observé la réaction vicieuse. Pour un effet dramatique supplémentaire, J'ai également mis du potassium dans l'eau et j'ai étonné tout le monde avec les flammes bleuâtres explosives.
Parce que les métaux du groupe I, également connu sous le nom de métaux alcalins, sont très réactifs, comme le sodium du wagon ou le potassium, on ne les trouve pas dans la nature à l'état pur mais seulement sous forme de sels. Non seulement ils sont très réactifs, ils sont doux et brillants, peuvent facilement être coupés même avec un couteau émoussé et sont les plus métalliques de tous les éléments connus.
Je suis un chimiste qui a passé sa carrière à construire de nouvelles molécules, utilisant parfois des éléments du groupe I. En étudiant le comportement et les tendances des éléments du groupe I, nous pouvons avoir un aperçu de la façon dont le tableau périodique est organisé et comment l'interpréter.
Les bases
L'arrangement du tableau périodique et les propriétés de chaque élément qu'il contient sont basés sur le numéro atomique et l'arrangement des électrons en orbite autour du noyau. Le numéro atomique décrit le nombre de protons dans le noyau de l'élément. Le numéro atomique de l'hydrogène est 1, l'hélium est 2, le lithium est 3 et ainsi de suite.
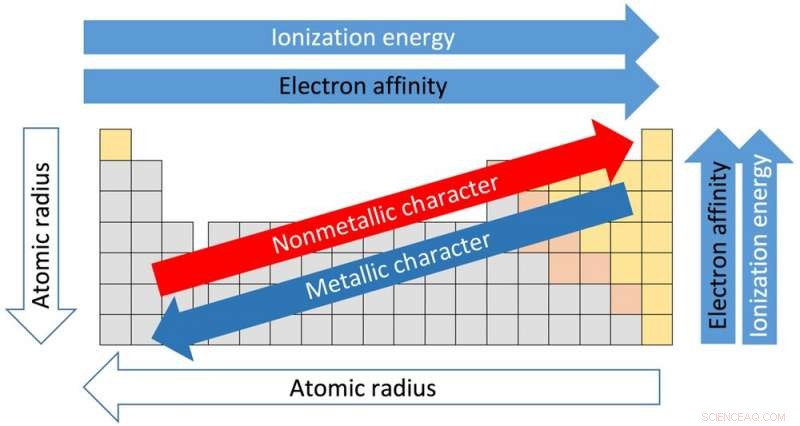
Chacune des 18 colonnes du tableau est appelée un groupe ou une famille. Les éléments du même groupe partagent des propriétés similaires. Et les propriétés peuvent être supposées en fonction de l'emplacement au sein du groupe. En allant du haut du groupe I vers le bas, par exemple, les rayons atomiques – la distance entre le noyau et les électrons externes – augmentent. Mais la quantité d'énergie nécessaire pour arracher un électron externe diminue de haut en bas car les électrons sont plus éloignés du noyau et ne sont pas tenus aussi fermement.
Ceci est important car la façon dont les éléments interagissent et réagissent les uns avec les autres dépend de leur capacité à perdre et à gagner des électrons pour fabriquer de nouveaux composés.
Les lignes horizontales du tableau sont appelées périodes. Déplacement du côté gauche de la période vers la droite, le rayon atomique devient plus petit parce que chaque élément a un proton supplémentaire et un électron supplémentaire. Plus de protons signifie que les électrons sont attirés plus étroitement vers le noyau. Pour la même raison, l'électronégativité - le degré auquel un élément a tendance à gagner des électrons - augmente de gauche à droite.
La force nécessaire pour retirer l'électron le plus externe, connu sous le nom de potentiel d'ionisation, augmente également à partir du côté gauche de la table, qui a des éléments à caractère métallique, sur le côté droit, qui sont des non-métaux.
L'électronégativité décroît du haut de la colonne vers le bas. Le point de fusion des éléments au sein d'un groupe diminue également du haut vers le bas d'un groupe.
Appliquer les bases aux éléments du groupe I
Comme son nom l'indique, Les éléments du groupe I occupent la première colonne du tableau périodique. Chaque élément commence une nouvelle période. Le lithium est en tête du groupe et est suivi par le sodium, N / A; potassium, K; rubidium, Rb; césium, Cs et se termine par le francium radioactif, Fr. Parce qu'il est hautement radioactif, pratiquement aucune chimie n'est effectuée avec cet élément.
Parce que chaque élément de cette colonne a un seul électron externe dans une nouvelle couche, les volumes de ces éléments sont importants et augmentent considérablement lorsqu'on passe du haut vers le bas du groupe.
De tous les éléments du groupe I, le césium a les volumes les plus importants parce que l'électron unique le plus externe est faiblement retenu.
Malgré ces tendances, les propriétés des éléments du groupe I sont plus similaires entre elles que celles de tout autre groupe.
Les métaux alcalins à travers l'histoire
En utilisant les propriétés chimiques comme guide, Le chimiste russe Dimitri Mendeleev a correctement ordonné les premiers éléments du groupe I dans son tableau périodique de 1869. Il est appelé périodique car chaque huitième élément répète les propriétés de celui au-dessus dans le tableau. Après avoir organisé tous les éléments alors connus, Mendeleev a pris la décision audacieuse de laisser des blancs là où son extrapolation des propriétés chimiques a montré qu'un élément devrait exister. La découverte ultérieure de ces nouveaux éléments a prouvé sa prédiction correcte.
Certains métaux alcalins étaient connus et utilisés à bon escient bien avant que Mendeleev ne crée le tableau périodique. Par exemple, l'Ancien Testament mentionne 31 fois le sel – une combinaison de sodium de métal alcalin et de chlore. Le Nouveau Testament y fait référence 10 fois et appelle le carbonate de sodium « neter » et le nitrate de potassium « salpêtre ».
On sait depuis l'antiquité que la cendre de bois produit un sel de potassium qui, lorsqu'il est combiné avec de la graisse animale, donnera du savon. Samuel Hopkins a obtenu le premier brevet américain le 31 juillet 1790, pour le savon en vertu de la nouvelle loi sur les brevets qui vient d'être promulguée par le président George Washington quelques mois plus tôt.
L'industrie pyrotechnique aime ces éléments du groupe I pour leurs couleurs vives et leur nature explosive. La combustion du lithium produit une couleur rouge cramoisie vive; sodium un jaune; lilas potassique; rouge rubidium; et violet de césium. Ces couleurs sont produites lorsque les électrons sautent de leur environnement d'origine en orbite autour du noyau et y reviennent.
L'horloge atomique au césium, le garde-temps le plus précis jamais développé, fonctionne en mesurant la fréquence des électrons de césium sautant entre les états d'énergie. Les horloges basées sur le saut d'électrons offrent un moyen extrêmement précis de compter les secondes.
D'autres applications incluent les lampes à vapeur de sodium et les batteries au lithium.
Dans mes propres recherches, j'ai utilisé les métaux du groupe I comme outils pour effectuer d'autres produits chimiques. Une fois que j'avais besoin d'alcool absolument sec, et le plus sec que j'ai pu acheter contenait encore d'infimes traces d'eau. La seule façon de se débarrasser du dernier reste d'eau était de traiter l'alcool contenant de l'eau avec du sodium - une façon plutôt dramatique d'éliminer l'eau.
Les éléments alcalins occupent non seulement la première colonne du tableau périodique, mais ils montrent également la plus grande réactivité de tous les groupes dans l'ensemble du tableau et ont les tendances les plus spectaculaires en termes de volume et de potentiel d'ionisation, tout en conservant une grande similitude entre eux.
Cet article est republié à partir de The Conversation sous une licence Creative Commons. Lire l'article original. 