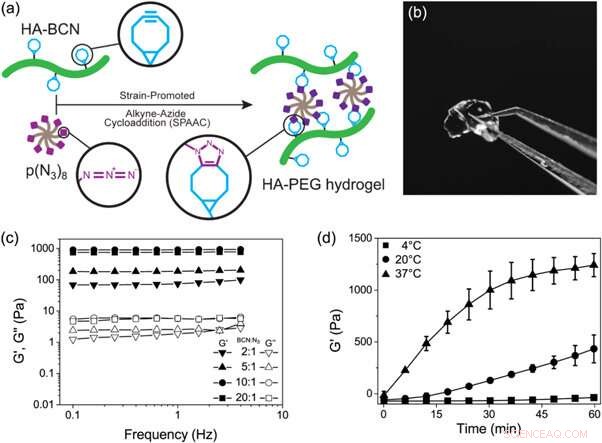
(a) Représentation schématique de la formation d'hydrogels HA-PEG par une réaction de cycloaddition alcyne-azide favorisée par la souche. (b) Photographie d'un hydrogel HA-PEG après formation. (c) Balayages de fréquence d'hydrogels HA-PEG avec différents rapports BCN à N3. (d) Expérience de temps de gélification montrant l'augmentation de G' au cours du temps pendant la gélification d'hydrogels HA-PEG (10:1 BCN:N3) à différentes températures. Crédit: Biofabrication , doi :https://doi.org/10.1088/1758-5090/aaf657
Les dispositifs de culture cellulaire de foie sur puce sont des modèles biomimétiques attrayants dans la découverte de médicaments, recherche en toxicologie et en génie tissulaire. Pour maintenir des fonctions spécifiques des cellules hépatiques sur une puce en laboratoire, les types de cellules et les conditions de culture adéquats doivent être respectés, qui comprend l'orientation des cellules en 3D et un approvisionnement constant en nutriments et en oxygène. Par rapport aux techniques conventionnelles de culture cellulaire 2D, Les dispositifs d'organes sur puce offrent une polyvalence et un biomimétisme efficace adaptés aux applications avancées dans la découverte de médicaments et la médecine.
Dans une étude récente maintenant publiée sur Biofabrication , Jonas Christoffersson et ses collègues ont démontré comment les hydrogels qui imitent la matrice extracellulaire peuvent soutenir la fonctionnalité et la viabilité des hépatocytes dans un dispositif de foie sur puce perfusé. Les chercheurs interdisciplinaires de la division de biotechnologie et de physique moléculaire ont conçu un système d'hydrogel à base de polymères hyaluronane et poly(éthylène glycol) (HA-PEG). Ils ont développé les hydrogels en utilisant la chimie du clic. Pour activer le processus, les scientifiques ont mené une réaction biorthogonale (chimie qui se produit dans les systèmes vivants sans l'interférence des réactions biochimiques natives) entre une fraction cyclooctyne et un partenaire de réaction marqué à l'azoture d'alcyne, connu sous le nom de cycloaddition d'azide d'alcyne à stimulation de contrainte (SPAAC).
Les nouveaux matériaux hydrogels ont été conçus et caractérisés par rapport aux hydrogels d'agarose et d'alginate existants pour la compatibilité cellulaire (cytocompatibilité). Pour les études de biofonctionnalisation, les chercheurs ont utilisé des hépatocytes dérivés de cellules souches pluripotentes induites humaines (hiPS-HEP). Pour améliorer la cytocompatibilité de surface du biomatériau, Les hydrogels HA-PEG ont été modifiés avec des motifs d'adhésion cellulaire modifiés par l'azide pour faciliter des attachements cellulaires efficaces. Dans le biomatériau fonctionnalisé en surface, les cellules souches hépatocytaires ont migré et se sont développées dans des orientations 3D, avec une viabilité accrue. Les scientifiques ont observé une production d'albumine plus élevée sur le nouveau matériau (protéine hépatique caractéristique), par rapport aux cellules cultivées sur d'autres hydrogels. Le souple, Le système d'hydrogel réticulé SPAAC avec culture cellulaire 3D perfusée de hiPS-HEP est un matériau prometteur pour optimiser les dispositifs de foie sur puce.
Les bioréacteurs miniaturisés dits « organ-on-chips », ont récemment émergé comme modèles alternatifs de culture cellulaire qui imitent mieux le microenvironnement biologique in vivo en laboratoire. Le foie est un modèle d'intérêt particulier dans la recherche médicale en raison de l'hépatotoxicité des médicaments observée à toutes les phases du développement clinique des médicaments. Des publications antérieures détaillent l'utilisation d'organes sur puce pour prédire le résultat de l'impact d'un médicament dans les essais cliniques et évaluer les interactions médicamenteuses avec les hépatocytes en laboratoire.
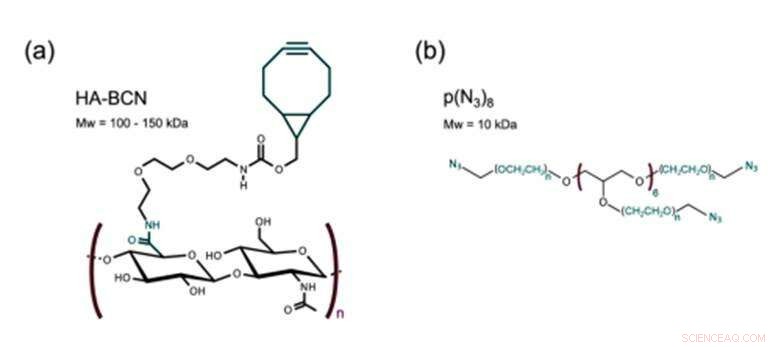
Structure de a) HA-BCN avec un rapport n/m de 0,19 et b) p(N3)8. Crédit: Biofabrication , doi :https://doi.org/10.1088/1758-5090/aaf657
En raison de leur adoption plus large dans les milieux universitaires et industriels, les bioréacteurs nécessitent des matériaux et des conditions optimisés pour une fabrication à haut débit. Les conditions incluent le remplacement du matériau de prototypage commun polydiméthylsiloxane (PDMS), intégrer des cellules dérivées de cellules souches pluripotentes induites (iPSC) sur un biomatériau mou qui facilite leur croissance et minimise le grand volume mort causé par les réservoirs microfluidiques et les tubes des dispositifs d'organes sur puces.
Le nouveau biomatériau préparé dans l'étude contenait deux constituants principaux réticulés via SPAAC; un hyaluronane modifié au cycloocytne (HA-BCN) et un PEG modifié à l'azide à plusieurs bras [p(N
Après, les scientifiques ont varié la composition des deux constituants principaux pour comprendre les propriétés viscoélastiques résultantes, tels que le module de stockage (G') et le module de perte (G") des hydrogels via la rhéologie oscillatoire (technique pour mesurer le comportement viscoélastique des matériaux mous). Ils ont contrôlé la cinétique de gélification du nouvel hydrogel à des températures croissantes. Cinétique de gélification de le nouveau biomatériau était suffisamment lent pour une distribution cellulaire homogène mais suffisamment rapide pour empêcher la sédimentation des cellules. applications de puces.
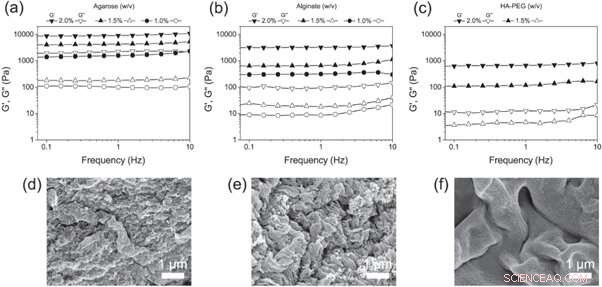
(a)–(c) Balayages de fréquence de (a) agarose, (b) alginate et (c) hydrogels HA-PEG à différentes concentrations. (d)–(f) Micrographies SEM de (d) agarose, (e) alginate et (f) hydrogels HA-PEG montrant la morphologie de chaque hydrogel. Crédit: Biofabrication , doi :https://doi.org/10.1088/1758-5090/aaf657
Christoffersson et al. ensuite comparé les hydrogels HA-PEG avec les échafaudages de culture cellulaire 3D bien établis - les hydrogels d'agarose et d'alginate. Afin de déterminer les propriétés viscoélastiques finales adaptées aux expériences de culture cellulaire 3D, ils ont utilisé la rhéologie oscillatoire pour examiner les différentes concentrations de polymère. Les scientifiques ont analysé la composition des matériaux finalisés à l'aide d'images de microscopie électronique à balayage (MEB).
La conception et la configuration du foie sur puce devaient répondre à deux critères clés de l'étude :
1. Autoriser la perfusion (passage de fluide) du milieu de culture cellulaire à travers la surface de l'hydrogel pour un échange constant de milieux nutritifs, vers et depuis les hépatocytes encapsulés.
2. Autoriser l'échantillonnage des milieux perfusés pour analyse expérimentale pendant la culture cellulaire en cours, sans affecter les hépatocytes et l'hydrogel.
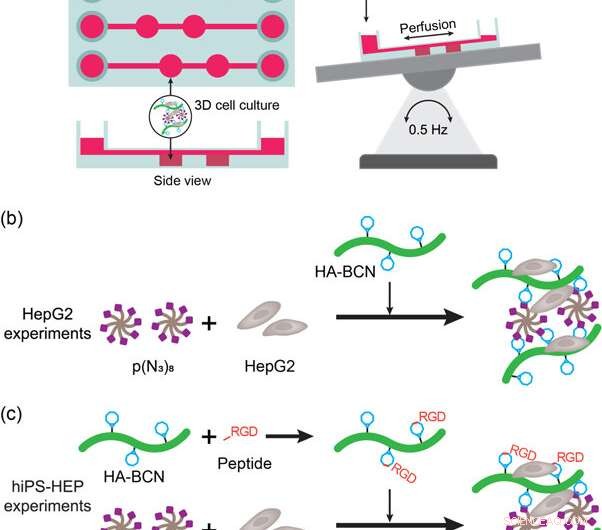
(a) Représentation schématique du dispositif et de la configuration du foie sur puce. L'appareil a été placé sur une table à bascule automatique pour permettre la perfusion de milieux et de nutriments pendant la culture cellulaire. (b) Représentation des expériences de culture cellulaire HepG2 3D avec des hydrogels HA-PEG. Les cellules HepG2 ont été ajoutées à p(N3)8 en suspension dans le milieu avant l'ajout de HA-BCN. (c) Représentation des expériences de culture cellulaire hiPS-HEP 3D avec des hydrogels HA-PEG. Les cellules hiPS-HEP ont été ajoutées à p(N3)8 en suspension dans le milieu avant l'ajout de HA-BCN. Dans les expériences utilisant le peptide linRGD ou cRGD, le HA-BCN a été pré-incubé avec 1 M de peptide correspondant pendant 1 h avant d'ajouter le composant HA-BCN(RGD) au mélange hiPS-HEP/p(N3)8. Crédit: Biofabrication , doi :https://doi.org/10.1088/1758-5090/aaf657
Pour répondre à ces critères, les scientifiques ont utilisé un dispositif commercial de culture cellulaire 3D (μ-Slide III 3D Perfusion IbiTreat) contenant deux chambres consécutives (2 x 30 µL) dans trois réseaux parallèles - chacun connecté à des réservoirs de média pour perfuser le liquide. Pour une perfusion efficace, ils ont monté le dispositif sur une table basculante automatique en inversant la direction du perfusat à travers les chambres contenant l'hydrogel. Le montage expérimental a permis la perfusion à travers le dispositif, remplissant les premiers critères. Pour remplir le deuxième critère, les parois localisées adjacentes aux chambres d'hydrogel ont permis aux scientifiques d'échantillonner le perfusat sans interférer avec l'hydrogel ou les constituants cellulaires.
Les scientifiques ont d'abord étudié la biofonctionnalisation de dispositifs de foie sur puce dans l'étude avec des cellules HEPG2 (lignée cellulaire de carcinome du foie) encapsulées dans des hydrogels, après 3, 7 et 9 jours de culture cellulaire. Ils ont comparé la morphologie cellulaire, viabilité et fonctionnalité avec les hydrogels d'agarose et d'alginate. L'étude comprenait des tests vivants/morts pour confirmer la viabilité des cellules et a confirmé davantage la fonctionnalité HepG2 en détectant les sécrétions d'albumine et d'urée dans le surnageant de la culture cellulaire.
Pour une meilleure fonctionnalité des cellules (fixation de surface et mobilité sur les matériaux), les scientifiques ont greffé des motifs d'adhésion cellulaire tels que des peptides RGD linéaires ou cycliques (linRGD linéaire ou cRGD cyclique) sur les hydrogels. Dans ce cas, Des cellules hiPS-HEP (cellules souches d'hépatocytes) ont été cultivées dans différentes compositions d'hydrogel pendant 13 jours pour examiner la morphologie et la viabilité (coloration vivante/morte) après les interactions cellule-matériau. Les scientifiques ont utilisé six surfaces différentes de biomatériaux à base d'hydrogel dans les expériences, notamment ; 2D (couche HEP), Agarose, Alginate, HA-PEG, HA-PEG (linRGD) et HA-PEG (cRGD).
Les cellules hiPS-HEP encapsulées et cultivées dans l'hydrogel modifié se sont développées dans des constructions 2D et 3D véritables. Pour tester la fonctionnalité des cellules hiPS-HEP cultivées (cellules souches), les scientifiques ont quantifié leur excrétion d'albumine et d'urée. Les résultats ont montré que seuls les surnageants de cellules souches cultivées dans des surfaces 2D et en présence des hydrogels du motif cRGD sécrétaient de l'albumine.
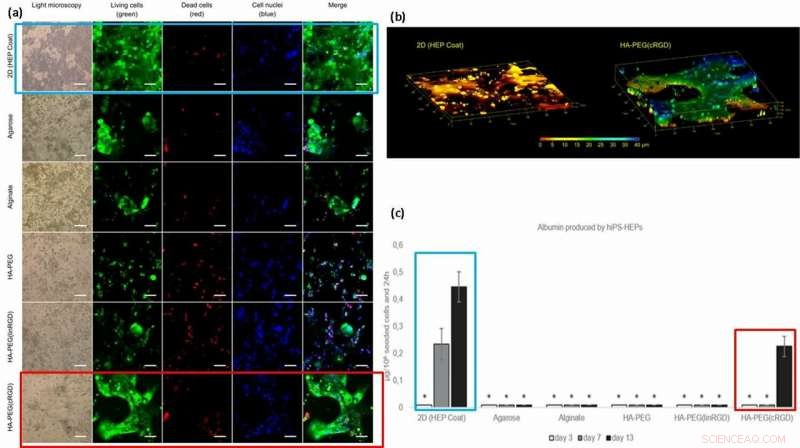
(a) Viabilité et morphologie des cellules hiPS-HEP après 13 jours de culture. La viabilité cellulaire semble dépendre de la capacité de la cellule à se fixer à la surface, l'hydrogel, ou l'un à l'autre. De grandes structures de hiPS-HEP ont été formées dans HA-PEG(cRGD). (calcéine, vert), cellules mortes (éthidium homodimère-1, rouge), et noyaux (Hoechst 33 342, bleu). (b) La pile Z d'images obtenues par microscopie confocale révèle la forme plate de hiPS-HEPS lorsqu'elle est cultivée sur un substrat 2D (à gauche) par rapport aux constructions 3D des cellules dans un hydrogel HA-PEG (cRGD) (à droite). Les couleurs représentent la hauteur au-dessus du fond de la chambre du dispositif de culture cellulaire 3D, c'est-à-dire l'axe Z, de 0 m (rouge) à 40 m (bleu). (c) Albumine produite par hiPS-HEP sur HEP Coat en 2D et dans les différents hydrogels. * indique que les niveaux de concentration d'albumine étaient trop faibles pour une quantification fiable. Crédit: Biofabrication , doi :https://doi.org/10.1088/1758-5090/aaf657
Sur la base des résultats, les scientifiques ont attribué la quantité plus élevée d'albumine sur la couche HEP 2D au taux de diffusion de l'albumine dans les hydrogels; le transfert sur la couche 2D est plus rapide qu'en 3D. La concentration plus élevée d'albumine avec les hydrogels liés au motif cRGD, corrélée avec l'augmentation de la croissance cellulaire et de la viabilité observée sur les surfaces de biomatériaux liés au cRGD. Par conséquent, les scientifiques ont l'intention d'utiliser des formes cycliques du peptide RGD pour aider à la culture de cellules souches d'hépatocytes sur des hydrogels préparés pour les dispositifs de foie sur puce à l'avenir.
De cette façon, l'étude a détaillé les avantages de l'utilisation d'hydrogel à base d'hyaluronane-PEG modifié avec des peptides RGD pour les cultures 3D d'hépatocytes (environ 13 jours) dans une configuration de foie sur puce. Comme repères de l'étude, Christofferfsson et ses collaborateurs ont utilisé les hydrogels d'alginate et d'agarose couramment disponibles. À l'avenir, les scientifiques optimiseront les propriétés viscoélastiques et la concentration des motifs d'adhésion cellulaire sur le système d'hydrogel HA-PEG pour la cytocompatibilité biomimétique. The optimized hydrogel system can be combined with the device setup to facilitate physiologically relevant liver-on-a-chip platforms for clinical research in drug toxicology, drug discovery and regenerative medicine.
© 2019 Science X Network