La triéthanolamine (TEOA) est activement engagée dans les étapes de réaction clés du cycle photocatalytique pour la conversion du dioxyde de carbone (CO2) par des complexes ruthénium carbonyle. Crédit: Journal de l'American Chemical Society
Les plantes puisent l'énergie de la lumière du soleil pour transformer le dioxyde de carbone atmosphérique (CO2) en sucres, puis en d'autres matériaux pour la croissance et les fonctions métaboliques. Imiter cette réaction photochimique pour convertir efficacement le CO2 en carburants et produits chimiques importants sur le plan industriel favoriserait un avenir énergétique durable et réduirait les émissions de gaz à effet de serre.
Pour réaliser une telle photosynthèse artificielle, les scientifiques ont étudié des systèmes catalytiques composés de plusieurs composants qui fonctionnent ensemble pour piloter le transfert d'électrons photo-induits requis pour convertir le CO2 en produits riches en énergie. Un de ces produits est le formiate, une forme de sel d'acide formique, un produit chimique organique naturel composé de molécules d'hydrogène et de CO2. La production de formiate à partir de CO2 est considérée comme une stratégie intéressante pour le stockage à long terme de l'énergie solaire renouvelable sous forme chimique.
Les systèmes de conversion de CO2 à plusieurs composants comprennent généralement un photosensibilisateur, un catalyseur, et un donneur d'électrons sacrificiel en solution. En absorbant la lumière, le photosensibilisateur passe à un état excité, où il accepte les électrons du donneur. Le catalyseur, dont la fonction est de minimiser la barrière à haute énergie pour activer le CO2, une molécule très stable, puis utilise ces électrons à haute énergie pour effectuer une série de réactions.
Pour de nombreuses études sur la conversion photochimique du CO2 à l'aide de catalyseurs moléculaires, tels que ceux à base de ruthénium et d'autres complexes métalliques, la triéthanolamine (TEOA) est le composant qui donne les électrons. Ou, dans certains cas, TEOA accepte un proton (ion hydrogène chargé positivement) d'un donneur d'électrons plus efficace pour assurer son comportement sacrificiel. Malgré la large utilisation de TEOA, une grande partie de la recherche à ce jour n'a pas envisagé la possibilité que cette composante joue des rôles secondaires, telles que le changement des espèces chimiques temporaires (intermédiaires) générées dans le cycle catalytique ou l'augmentation des vitesses de réaction.
Une équipe de chimistes du laboratoire national de Brookhaven du Département de l'énergie des États-Unis (DOE) et du Baruch College de l'Université de la ville de New York a décidé de changer cela.
« Depuis 40 ans, la plupart des études sur les catalyseurs de réduction de CO2 se sont concentrées sur l'analyse de l'efficacité catalytique et de la sélectivité du produit final, " dit Renato Sampaio, un associé de recherche dans le groupe de photosynthèse artificielle de la division de chimie du Brookhaven Lab. "Toutefois, il est important de savoir si et comment TEOA interagit avec le catalyseur au cours des étapes intermédiaires du cycle catalytique, car ces interactions peuvent influencer de manière décisive l'efficacité et la sélectivité de la formation du produit."
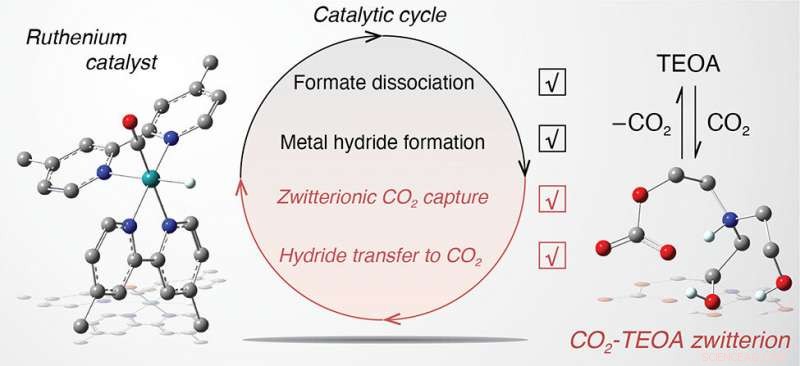
En se concentrant sur un système catalytique bien connu dans une solution d'acétonitrile constituée d'un catalyseur ruthénium carbonyle (atome de carbone lié à un atome d'oxygène), un photosensibilisateur à base de ruthénium, un donneur d'électrons commun connu sous le nom de BIH, et TEOA agissant comme un accepteur de protons pour favoriser le comportement sacrificiel de BIH, les chimistes firent des découvertes surprenantes. Comme ils l'ont signalé dans un article publié en ligne le 27 décembre dans le Journal de l'American Chemical Society , TEOA échoue à sa tâche principale d'accepter efficacement les protons de BIH, limitant ainsi l'activité catalytique. Cependant, TEOA valorise les étapes clés du cycle catalytique de conversion du CO2 en formiate, le produit cible.

Dans la division de chimie de Brookhaven Lab, (à partir de la droite) David Grills, Renato Sampaio, et Etsuko Fujita discutent des résultats d'une étude spectroélectrochimique de l'un d'une série de catalyseurs au ruthénium carbonyle tandis que Dmitry Polyansky met en place une cellule électrochimique pour la prochaine expérience. L'équipe, comprenant également David Szalda du Baruch College (non représenté), ont découvert qu'un composant largement utilisé dans la réduction photochimique (induite par la lumière) du dioxyde de carbone en produits riches en énergie utilisables améliore les étapes clés du cycle catalytique. Crédit :Laboratoire national de Brookhaven
Par exemple, La TEOA agit comme une source de protons favorisant la formation d'un hydrure métallique (ruthénium attaché à l'hydrogène) qui interagit ensuite avec le CO2 pour fabriquer du formiate lié (lié au ruthénium). De plus, TEOA interagit avec le CO2 pour former un "adduit zwitterionique, " une molécule contenant à la fois des charges électriques positives et négatives. Lorsque cet adduit est présent en solution, l'hydrure métallique interagit avec le CO2 pour produire du formiate lié à une vitesse de six ordres de grandeur plus rapide que celle sans TEOA. La dissociation du formate lié en formate « libre » - qui peut être capturé comme produit final - est également plus rapide de six ordres de grandeur en raison de la TEOA.
Pour faire ces déterminations, l'équipe a collecté des données électrochimiques et spectroscopiques.
« Le cycle catalytique peut générer un grand nombre d'intermédiaires réactionnels, " a expliqué l'auteur co-correspondant Etsuko Fujita, chef du groupe de photosynthèse artificielle. "Le défi est de les caractériser par des techniques spectroscopiques ou électrochimiques."
D'abord, l'équipe a mesuré les potentiels de réduction du catalyseur (la facilité avec laquelle le catalyseur gagne un électron) en présence et en l'absence de TEOA. Puis, ils ont caractérisé les vibrations spectroscopiques du carbonyle pour différentes formes du catalyseur avant et après qu'il reçoive un électron. Suite à ces mesures électrochimiques, ils ont mené des expériences de spectroscopie infrarouge à résolution temporelle sur des échelles de temps de la nanoseconde pour surveiller les intermédiaires catalytiques dans une atmosphère de CO2.
« Le carbonyle lié au ruthénium nous a permis d'étudier chaque forme intermédiaire transitoire du catalyseur, " a expliqué Sampaio. " Le carbonyle est un rapporteur spectroscopique infrarouge très sensible qui reste lié au ruthénium tout au long du cycle catalytique, contrairement aux autres parties du catalyseur. Sa fréquence vibratoire, ou mouvement atomique, se déplace considérablement lorsque le catalyseur accepte un électron ou subit d'autres changements structurels. Nous pouvons détecter ces changements et les visualiser avec les mesures électrochimiques pour dire quelles espèces sont présentes."
Dans les études futures, l'équipe explorera des alternatives au TEOA qui maximisent la capacité sacrificielle du BIH tout en offrant des avantages similaires dans l'amélioration du cycle catalytique.
« Même si notre étude portait sur une classe spécifique de catalyseurs, nous croyons fermement que nos résultats sont largement applicables à d'autres systèmes et devraient être pris en considération lors de l'étude de la réduction catalytique du CO2 en formate, " dit Fujita.