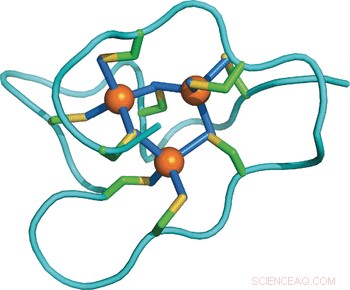
Adaptation structurelle d'une protéine à un stress métallique accru :structure RMN d'une métallothionéine d'escargot marin avec un domaine supplémentaire. Crédit :Wiley
Un type spécial de petite protéine riche en soufre, métallothionéines, ont une capacité extraordinaire pour lier les métaux lourds. Une équipe internationale de scientifiques a maintenant découvert que la pervenche commune marine, qui est largement considéré comme un mets délicat, contient la plus grande version de la protéine trouvée à ce jour, avec un domaine de liaison au cadmium supplémentaire et une capacité de détoxification supérieure d'un tiers. Comme ils le rapportent dans le journal Angewandte Chemie , cette caractéristique peut aider l'escargot à survivre dans des environnements pollués par des métaux lourds.
Les escargots et les limaces sont connus pour leur capacité intrigante à accumuler et à détoxifier les métaux lourds. Ils sont même capables de discriminer entre le cadmium et le cuivre, comme ce dernier élément est un élément indispensable dans leur métabolisme, tandis que le cadmium est toxique. Ils détoxifient le cadmium en le liant aux métallothionéines, une classe de petites protéines riches en acide aminé cystéine contenant du soufre. Oliver Zerbe à l'Université de Zurich, La Suisse, et Reinhard Dallinger à l'Université d'Innsbruck, L'Autriche, et leurs collègues de Barcelone, Espagne, étudier l'évolution de ces protéines comme stratégie pour adapter les gastéropodes à leurs nouveaux habitats - les escargots terrestres se sont développés à partir d'espèces marines, et a dû trouver de nouvelles stratégies pour faire face aux charges plus élevées de métaux lourds dans le sol. Des environnements encore plus rudes se trouvent au bord de la mer avec leur approvisionnement en eau fluctuant. Comme les scientifiques l'ont découvert, le gastéropode marin Littorina littorea (pervenche commune), qui a colonisé avec beaucoup de succès les rivages de l'Atlantique Nord, a trouvé une stratégie particulière pour une désintoxication encore plus efficace.
Étudier les différences moléculaires entre les protéines de diverses espèces, les scientifiques ont résolu la structure en solution de la métallothionéine de la pervenche en utilisant des techniques de résonance magnétique nucléaire et l'ont comparée à d'autres structures et séquences connues. Étonnamment, la protéine de la pervenche comprend trois domaines indépendants, tandis que d'autres métallothionéines connues n'en ont qu'une ou deux. Chacun des trois domaines contient neuf résidus de cystéine liant un groupe de trois ions cadmium, ainsi, les 27 résidus de cystéine au total peuvent incorporer neuf ions cadmium. Cela éclaire la stratégie d'adaptation :"L'augmentation du nombre de domaines augmente simplement la capacité de fixation des métaux de la protéine et potentialise ainsi sa capacité de détoxification des métaux, " ont écrit les auteurs.
Concernant les caractéristiques structurelles, le complexe formé avec le cadmium est très similaire à celui de l'escargot romain, qui peut efficacement discriminer entre les ions cuivre vitaux pour les escargots et le cadmium toxique. Et en plus de simplement faire face à des environnements riches en cadmium et de sélectionner le cuivre parmi d'autres métaux lourds, les métallothionéines riches en cystéine sont considérées comme d'importantes protéines de réponse au stress oxydatif. Le stress est l'une des rencontres majeures de la pervenche commune, qui peut survivre à une mer agitée et à la sécheresse en même temps.