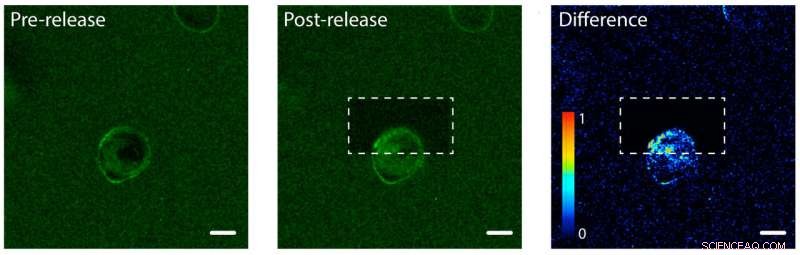
Photolibération de protéines du facteur de croissance épidermique (EGF) d'un côté d'une cellule humaine. Gauche :EGF (vert) est attaché à un hydrogel d'une seule cellule humaine (centre). La membrane cellulaire se lie à l'EGF, rendant sa membrane verte. Milieu :L'hydrogel après avoir utilisé un laser pour détacher et libérer les protéines EGF sur la partie supérieure de la cellule. À droite :une image montrant la différence de couleur verte fluorescente entre les images post-publication et pré-publication. Notez l'augmentation de la couleur dans la partie supérieure de la cellule, ce qui indique que la cellule a commencé à internaliser les protéines EGF non attachées mais seulement d'un côté. La barre d'échelle est de 10 micromètres. Crédit :Shadish, Benuska et DeForest, 2019, Matériaux naturels
L'ingénierie tissulaire pourrait transformer la médecine. Au lieu d'attendre que notre corps repousse ou répare les dommages après une blessure ou une maladie, les scientifiques pourraient devenir complexes, tissus entièrement fonctionnels dans un laboratoire pour transplantation chez des patients.
Les protéines sont la clé de cet avenir. Dans nos corps, les signaux protéiques indiquent aux cellules où aller, quand diviser et que faire. Dans le laboratoire, les scientifiques utilisent des protéines dans le même but :placer des protéines à des points spécifiques sur ou dans des échafaudages conçus, puis en utilisant ces signaux protéiques pour contrôler la migration cellulaire, division et différenciation.
Mais les protéines dans ces milieux sont également fragiles. Pour qu'ils s'accrochent aux échafaudages, les chercheurs ont traditionnellement modifié les protéines en utilisant des substances chimiques qui tuent plus de 90 pour cent de leur fonction. Dans un article publié le 20 mai dans la revue Matériaux naturels , une équipe de chercheurs de l'Université de Washington a dévoilé une nouvelle stratégie pour garder les protéines intactes et fonctionnelles en les modifiant à un point spécifique afin qu'elles puissent être chimiquement attachées à l'échafaudage à l'aide de la lumière. Étant donné que l'attache peut également être coupée à la lumière laser, cette méthode peut créer des modèles évolutifs de protéines de signal dans un échafaudage de biomatériau pour faire croître des tissus constitués de différents types de cellules.
"Les protéines sont les communicateurs ultimes de l'information biologique, " a déclaré l'auteur correspondant Cole DeForest, un professeur assistant de l'UW en génie chimique et en bio-ingénierie, ainsi qu'un chercheur affilié à l'UW Institute for Stem Cell &Regenerative Medicine. « Ils entraînent pratiquement tous les changements dans la fonction cellulaire :différenciation, mouvement, croissance, décès."
Pour cette raison, les scientifiques utilisent depuis longtemps des protéines pour contrôler la croissance et la différenciation cellulaires en génie tissulaire.
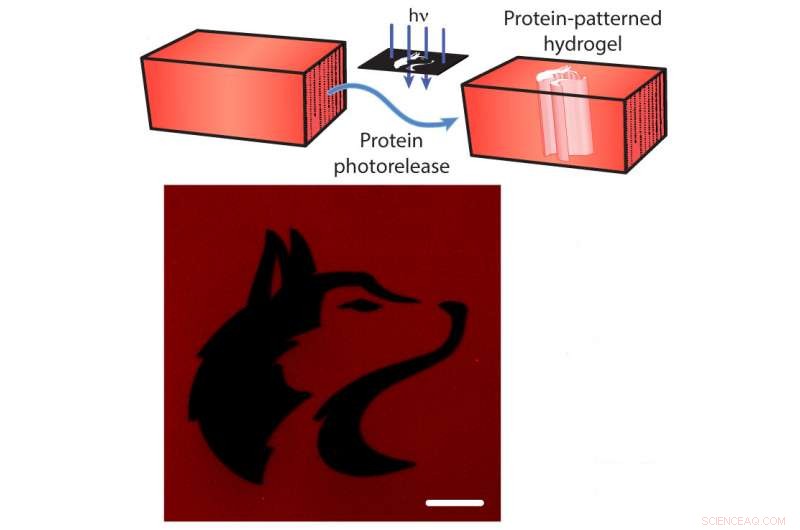
Photolibération de protéines à partir d'un hydrogel. En haut :les protéines fluorescentes rouges mCherry sont attachées à l'hydrogel. Les chercheurs peuvent fendre l'attache avec une lumière dirigée (flèches bleues), libérant le mCherry de l'hydrogel (flèches bleues). En bas :une image de l'hydrogel après la libération de mCherry ayant la forme de la mascotte de l'Université de Washington (noir). La barre d'échelle est de 100 micromètres. Crédit :Shadish, Benuska et DeForest, 2019, Matériaux naturels.
"Mais les chimies les plus couramment utilisées par la communauté pour lier les protéines aux matériaux, y compris les échafaudages pour l'ingénierie tissulaire, détruire l'écrasante majorité de leur fonction, " a déclaré DeForest, qui est également membre du corps professoral de l'UW Molecular &Engineering Sciences Institute. « Historiquement, les chercheurs ont essayé de compenser cela en surchargeant simplement l'échafaudage avec des protéines, sachant que la plupart d'entre eux seront inactifs. Ici, nous avons trouvé un moyen généralisable de fonctionnaliser de manière réversible les biomatériaux avec des protéines tout en préservant leur pleine activité. »
Leur approche utilise une enzyme appelée sortase, qui se trouve dans de nombreuses bactéries, d'ajouter un court peptide synthétique à chaque protéine signal à un endroit précis :l'extrémité C-terminale, un site présent sur chaque protéine. L'équipe conçoit ce peptide de telle sorte qu'il attache la protéine signal à des emplacements spécifiques au sein d'un échafaudage de biomatériau rempli de fluide commun en ingénierie tissulaire, connu sous le nom d'hydrogel.
Cibler un seul site sur la protéine signal est ce qui distingue l'approche de l'équipe UW. D'autres méthodes modifient les protéines de signal en attachant des groupes chimiques à des emplacements aléatoires, ce qui perturbe souvent la fonction de la protéine. Modifier uniquement l'extrémité C-terminale de la protéine est beaucoup moins susceptible de perturber sa fonction, selon DeForest. L'équipe a testé l'approche sur plus d'une demi-douzaine de types de protéines différents. Les résultats montrent que la modification de l'extrémité C-terminale n'a pas d'effet significatif sur la fonction des protéines, et attache avec succès les protéines dans tout l'hydrogel.
Leur approche est analogue à accrocher une œuvre d'art encadrée sur un mur. Au lieu de marteler des clous au hasard à travers le verre, toile et cadre, ils enfilent un seul fil à l'arrière de chaque cadre pour l'accrocher au mur.
En outre, les attaches peuvent être coupées par exposition à une lumière laser focalisée, provoquant une "photolibération" des protéines. L'utilisation de ce sabre laser scientifique permet aux chercheurs de charger un hydrogel avec de nombreux types de signaux protéiques différents, puis exposer l'hydrogel à la lumière laser pour détacher les protéines de certaines sections de l'hydrogel. En exposant sélectivement seulement des parties des matériaux à la lumière laser, l'équipe a contrôlé où les signaux de protéines resteraient attachés à l'hydrogel.

De gauche à droite :Cole DeForest, Gabrielle Benuska, Jared Shadish. Crédit :Dennis Wise/Université de Washington
Le détachement des protéines est utile dans les hydrogels car les cellules pourraient alors capter ces signaux, les amenant à l'intérieur de la cellule où ils peuvent affecter des processus tels que l'expression des gènes.
L'équipe de DeForest a testé le processus de photolibération à l'aide d'un hydrogel chargé de facteur de croissance épidermique, un type de signal protéique. Ils ont introduit une lignée cellulaire humaine dans l'hydrogel et observé les facteurs de croissance se liant aux membranes cellulaires. L'équipe a utilisé un faisceau de lumière laser pour détacher les signaux protéiques d'un côté d'une cellule individuelle, mais pas de l'autre côté. Du côté captif de la cellule, les protéines sont restées à l'extérieur de la cellule car elles étaient toujours collées à l'hydrogel. Du côté non attaché, les signaux protéiques ont été internalisés par la cellule.
« En fonction de la façon dont nous ciblons la lumière laser, nous pouvons nous assurer que différentes cellules - ou même différentes parties de cellules individuelles - reçoivent des signaux environnementaux différents, " a déclaré DeForest.
Ce niveau de précision unique au sein d'une seule cellule aide non seulement à l'ingénierie tissulaire, mais avec la recherche fondamentale en biologie cellulaire, a ajouté DeForest. Les chercheurs pourraient utiliser cette plate-forme pour étudier comment les cellules vivantes répondent à de multiples combinaisons de signaux protéiques, par exemple. Cette ligne de recherche aiderait les scientifiques à comprendre comment les signaux protéiques fonctionnent ensemble pour contrôler la différenciation cellulaire, guérir les tissus malades et promouvoir le développement humain.
"Cette plate-forme nous permet de contrôler avec précision quand et où les signaux de protéines bioactives sont présentés aux cellules dans les matériaux, ", a déclaré DeForest. "Cela ouvre la porte à de nombreuses applications passionnantes dans le domaine de l'ingénierie tissulaire et de la recherche thérapeutique."