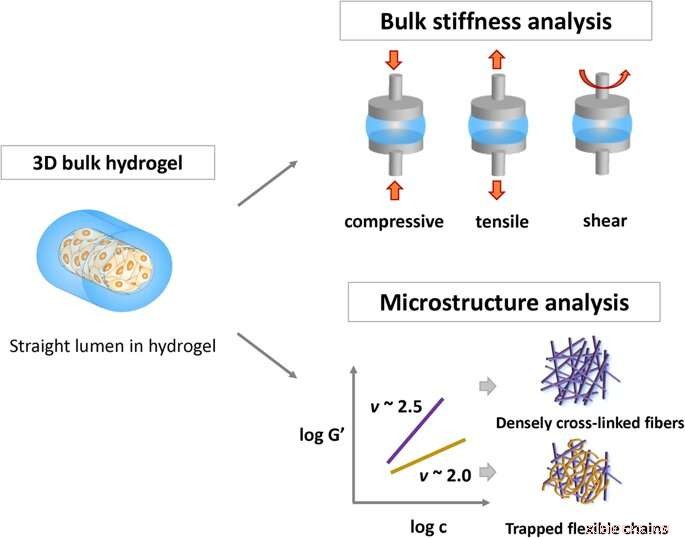
Représentation schématique des méthodes de caractérisation des propriétés physiques de l'hydrogel :la rigidité apparente de l'hydrogel et la flexibilité de la chaîne dans les réseaux viscoélastiques à travers le modèle semi-flexible. Crédit: Rapports scientifiques , doi :https://doi.org/10.1038/s41598-019-38951-7
Les hydrogels sont couramment utilisés comme biomatériaux pour des applications en biomédecine en raison de leur biocompatibilité. Cependant, la relation entre les cellules biologiques et la surface de l'hydrogel n'est toujours pas claire et les paramètres existants pour expliquer les interactions ne sont pas assez sophistiqués. Dans une étude récente, Jooyoung Lee, Boa Song et ses collègues du Center for Biomaterials et du Department of Polymer Engineering de la République de Corée ont étudié l'impact de la flexibilité de la chaîne polymère sur l'adhésion cellulaire, avec une variété de constructions d'hydrogel composées de polymères naturels de collagène et de fibrine.
Ils ont introduit une nouvelle méthode de semi-flexible, analyse basée sur un modèle pour confirmer que la flexibilité de la chaîne médie la microstructure de l'hydrogel en tant que facteur critique qui a permis l'adhésion cellulaire à l'interface cellule-matériau. L'analyse proposée dans l'étude est capable de prédire avec plus de précision la biocompatibilité (cytocompatibilité) des hydrogels. Les résultats des travaux maintenant publiés dans Rapports scientifiques, fournir un critère important pour la conception et le développement de polymères en améliorant la biocompatibilité et la biofonctionnalisation à l'interface cellule-matériau pour les applications biomédicales in vivo.
Les hydrogels sont constitués de réseaux de polymères gonflés d'eau et ont des applications dans l'administration de médicaments et l'ingénierie tissulaire. L'adhésion cellule-matériau est cruciale pour la biocompatibilité in vivo et la plupart des études ont testé le comportement des cellules en analysant la rigidité en vrac de la composition des matériaux. Néanmoins, la communication entre les cellules à la surface de l'hydrogel reste à comprendre avec précision. La FDA a approuvé les polymères naturels collagène et fibrine, offrent une excellente biocompatibilité pour les applications biomédicales. Aussi connus sous le nom de polymères semi-flexibles, ils ne sont pas conformes aux modèles de solutions de chaînes flexibles ou de réseaux à tiges rigides. Le modèle semi-flexible permet la prédiction de la flexibilité de la chaîne des réseaux polymères en mettant à l'échelle expérimentalement le module de plateau élastique.
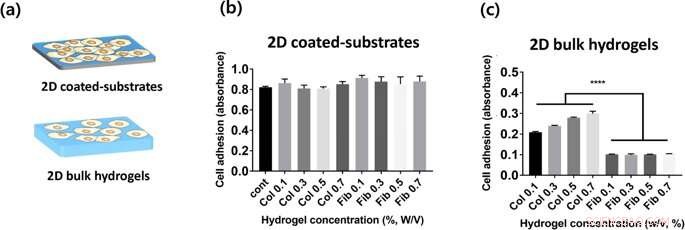
(a) Représentation de 2 types de constructions d'hydrogel évaluées dans cette étude. (b, c) Adhésion des cellules HUVEC sur des gels de collagène et de fibrine sur les surfaces supérieures des plaques revêtues d'hydrogel 2D (b) et de l'hydrogel en vrac (c), qui est mesurée par dosage CCK-8 2h après l'ensemencement. Crédit: Rapports scientifiques , doi :https://doi.org/10.1038/s41598-019-38951-7
Dans la nouvelle étude, Lee et Song et al. a proposé un nouveau, analyse basée sur un modèle semi-flexible pour comprendre l'adhésion cellulaire aux hydrogels en utilisant les polymères de collagène et de fibrine bien caractérisés. Ils ont utilisé trois constituants différents de collagène et de fibrine, pour étudier les facteurs qui ont déterminé l'adhésion cellulaire :
Les scientifiques ont fait varier la concentration d'hydrogel dans les constituants du matériau de 1 mg/mL à 7 mg/mL et ont quantifié la rigidité et la rugosité en vrac des biomatériaux nouvellement formés. Pour définir les paramètres d'attachement des cellules, ils ont observé la morphologie en chaîne des nouveaux matériaux. Les résultats ont confirmé que la microarchitecture des hydrogels affectait la flexibilité de la chaîne en tant que facteur crucial affectant l'adhésion cellulaire.
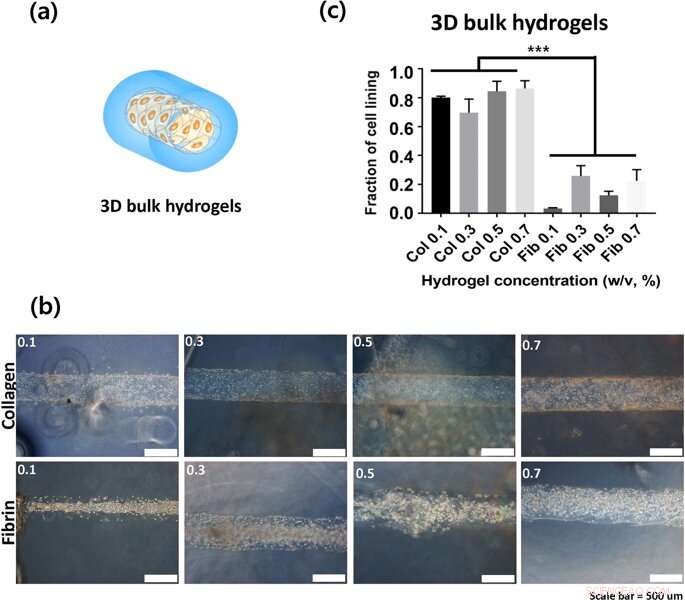
(a) Représentation des constructions d'hydrogel en vrac 3D (b) La surface interne des canaux creux dans lesquels les images ont été capturées 24 heures après l'ensemencement. (c) La fraction de revêtement cellulaire comme quantification de l'adhésion cellulaire. Crédit: Rapports scientifiques , doi :https://doi.org/10.1038/s41598-019-38951-7
Dans le montage expérimental, les scientifiques ont préparé une variété de constructions de collagène et de fibrine, pour tester l'adhésion cellulaire sans effets de gravité. Ils ont contrôlé la rigidité de l'hydrogel en utilisant des concentrations incrémentielles de chaque composant et ont quantifié la relation contrainte-déformation en fonction de la contrainte axiale (traction ou compression) et rotationnelle (cisaillement). Pour mesurer les propriétés rhéologiques des hydrogels, les scientifiques ont utilisé un rhéomètre à contrainte contrôlée. Ils ont ensuite mesuré le module de compression pour les essais de traction avec une machine d'essai universelle. Pour étudier la topographie de surface, les scientifiques ont utilisé un microscope à force atomique, suivi d'une microindentation pour mesurer le module d'Young (E) des hydrogels, où ils ont calculé la moyenne (E) à l'aide du logiciel de traitement de données JPK. Lee et Song et al. pensent que l'étude était la première à étudier l'adhésion cellulaire sur des hydrogels en utilisant la pente d'élasticité de polymères semi-flexibles modèles.
Pour la culture cellulaire en laboratoire, Lee et Song et al. utilisé des cellules endothéliales de veine ombilicale humaine (HUVEC) comme lignée cellulaire préférée. Ils ont mesuré le taux d'adhésion cellulaire sur diverses concentrations d'hydrogels de collagène et de fibrine en 2D, et l'adhésion cellulaire quantifiée à l'aide du kit de comptage cellulaire 8 (CCK-8). Les scientifiques n'ont pas observé de différence statistiquement significative entre l'adhésion cellulaire sur des substrats enduits de collagène 2-D et de fibrine; peut-être parce que les cellules ont ressenti les propriétés mécaniques des plaques de culture cellulaire, au lieu des propriétés matérielles des hydrogels. Dans les surfaces d'hydrogel en vrac 2-D, l'adhésion cellulaire au collagène (gels en vrac 2-D) était beaucoup plus élevée que celle sur les gels en vrac de fibrine 2-D. Par ailleurs, comme la concentration d'hydrogel variait, les scientifiques ont observé que l'attachement cellulaire augmentait systématiquement avec l'augmentation de la concentration de collagène. En comparaison, l'adhésion cellulaire sur les gels de fibrine était indépendante de la concentration de l'hydrogel incorporé.
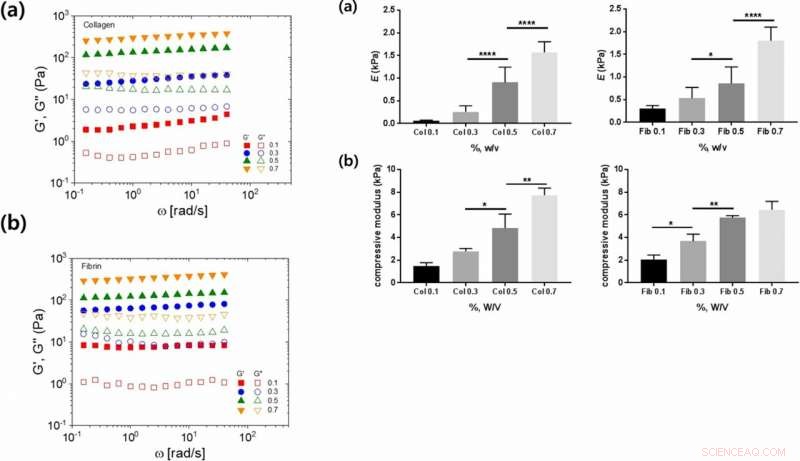
Gauche :Propriétés viscoélastiques linéaires des hydrogels de collagène et de fibrine en fonction de diverses concentrations d'hydrogel :(a, b) dépendance en fréquence angulaire du stockage (G′, symboles pleins) et la perte (G″, symboles ouverts) modules pour (a) le collagène et (b) les hydrogels de fibrine. À droite :Propriétés mécaniques des hydrogels de collagène et de fibrine à différentes concentrations :(a) Module de Young et (b) module de compression en fonction de la concentration de gel de collagène ou de fibrine. Crédit: Rapports scientifiques , doi :https://doi.org/10.1038/s41598-019-38951-7
Lee et Song et al. ont ensuite utilisé des structures de lumière 3-D d'hydrogels pour clarifier le taux d'adhésion cellulaire sur des gels de collagène et de fibrine. Ils ont observé que les cellules étaient mieux attachées au collagène par rapport aux gels de fibrine. Les phénotypes d'adhésion cellulaire étaient également beaucoup plus clairs sur les constructions 3-D par rapport aux pièces jointes sur 2-D. Typiquement, les cellules se fixent aux surfaces matérielles ou à la matrice extracellulaire (ECM) via des points d'ancrage appelés adhérences focales. Les cellules sur des substrats plus rigides contiennent généralement des cytosquelettes bien organisés pour des adhérences focales stables. Pour comprendre si les hydrogels en vrac pourraient contribuer à l'adhésion cellulaire, les scientifiques ont tracé la rigidité en vrac des hydrogels et comparé le collagène et la fibrine à différentes concentrations. Lee et Song et al. ainsi montré expérimentalement que la rigidité en vrac n'était pas un facteur critique pour impacter l'adhésion cellulaire sur les hydrogels.
Les scientifiques ont déterminé que le module de Young et le module de compression étaient des propriétés mécaniques supplémentaires des matériaux qui influençaient l'adhésion cellulaire. Ils ont montré comment la rigidité augmentait avec l'augmentation de la concentration, et la flexibilité de la chaîne suggérée comme paramètre approprié. Malgré la rigidité accrue avec l'augmentation de la concentration de collagène et de fibrine, les scientifiques n'ont pas pu expliquer les taux variables d'adhésion cellulaire observés entre les deux polymères.
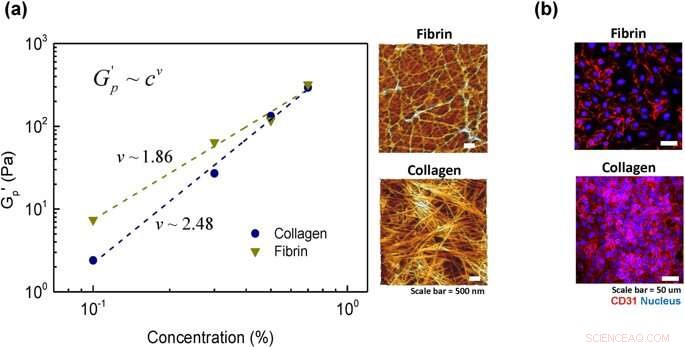
Analyse de la flexibilité de la chaîne de l'hydrogel :(a) mise à l'échelle de la loi de puissance du module plateau avec une concentration d'hydrogel pour le collagène et la fibrine. Les lignes en tirets sont les résultats d'ajustements à l'équation de la loi de puissance G'p=cv et à la microstructure de deux échantillons représentatifs d'une concentration de 0,5% chacun dans le collagène et la fibrine. (b) marqueur de surface cellulaire, CD31, après cellules ensemencées pendant 2h30 pour deux échantillons représentatifs de collagène et de fibrine (concentration 0,5%). Crédit: Rapports scientifiques , doi :https://doi.org/10.1038/s41598-019-38951-7
Pour ça, Lee et Song et al. ont examiné l'architecture des molécules de fibres et de leurs réseaux à l'échelle microscopique en utilisant la microscopie à force atomique. Les gels de collagène présentaient une structure fibreuse comme indiqué précédemment, avec une forme de tige bien définie, filaments semi-flexibles. En comparaison, dans la structure du gel de fibrine, les scientifiques n'ont observé que quelques filaments semi-flexibles, où la protéine associée était enchevêtrée sous forme de chaînes flexibles piégées dynamiquement. Pour confirmer le degré de cellule sur l'attachement d'hydrogel, les scientifiques ont coloré les cellules avec le marqueur de surface cellulaire CD31 (glycoprotéine exprimée sur les cellules endothéliales) et confirmé l'architecture stable de l'endothélium sur le matériau.
Les scientifiques ont observé que l'attachement cellulaire total à l'hydrogel de collagène était plus important que sur l'hydrogel de fibrine. Les résultats étaient dus à la rigidité plus élevée du collagène à l'échelle microscopique, par rapport à l'architecture de chaîne relativement flexible de la fibrine. Les scientifiques ont ainsi montré que la rigidité microscopique des hydrogels était un facteur dominant qui déterminait le degré d'attachement des cellules sur une surface de biomatériau.
De cette façon, Lee et Song et al. méthodes analytiques proposées dans l'étude pour décrire l'interaction entre l'adhésion cellulaire et les surfaces des matériaux. Les résultats fourniront des lignes directrices importantes lors de la conception de biomatériaux à l'avenir, tout en intégrant des propriétés matérielles optimisées de durabilité et de résistance mécanique pour les applications d'hydrogel in vivo. Les scientifiques ont démontré un semi-flexible, explication basée sur un modèle de l'adhésion cellulaire aux biomatériaux en étudiant la rigidité des tissus pour contrôler l'adhésion cellulaire, prolifération et différenciation sur les constructions matérielles. Les auteurs proposent que cette méthode simple puisse expliquer les propriétés d'adhésion cellulaire sur les biomatériaux polymères pour des prédictions précises de la biocompatibilité. Les résultats fourniront un outil pratique pour concevoir et construire des tissus artificiels en 3D avec une précision biomécanique et une biocompatibilité plus élevées pour une variété d'applications, tels que la bio-ingénierie des vaisseaux sanguins et des mécanismes d'administration de médicaments in vivo.
© 2019 Réseau Science X