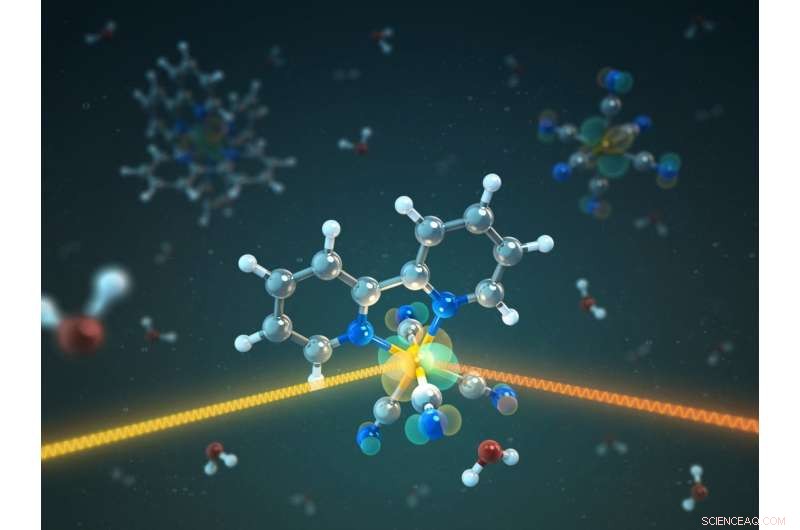
L'illustration montre une molécule avec un atome de fer en son centre, lié à 4 groupes CN et à une molécule de bipyridine. La plus haute orbitale de fer occupée est représentée par un nuage vert-rouge. Dès qu'un groupe cyan est présent, on observe que les orbitales de fer externes se délocalisent de sorte que les électrons sont également densément présents autour des atomes d'azote. Crédit :T. Splettstoesser/HZB
Une équipe de BESSY II a étudié comment divers composés du complexe de fer traitent l'énergie de la lumière incidente. Ils ont pu montrer pourquoi certains composés ont le potentiel de convertir la lumière en énergie électrique. Les résultats sont importants pour le développement de cellules solaires organiques. L'étude vient d'être publiée dans la revue Chimie Physique Physique Chimique .
Les complexes de métaux de transition ont des propriétés importantes :un élément du groupe des métaux de transition se trouve au centre. Les électrons externes de l'atome de métal de transition sont situés dans des orbitales d étendues en forme de trèfle qui peuvent être facilement influencées par une excitation externe. Certains complexes de métaux de transition agissent comme des catalyseurs pour accélérer certaines réactions chimiques, et d'autres peuvent même convertir la lumière du soleil en électricité. La célèbre cellule solaire à colorant développée par Michael Graetzel (EPFL) dans les années 1990 est basée sur un complexe de ruthénium.
Cependant, il n'a pas encore été possible de remplacer le rare et coûteux métal de transition ruthénium par un élément moins coûteux, comme le fer. C'est notable, parce que le même nombre d'électrons se trouve sur les orbitales d externes étendues du fer. Cependant, l'excitation avec la lumière de la région visible ne libère pas de porteurs de charge à longue durée de vie dans la plupart des composés du complexe de fer étudiés jusqu'à présent.
Une équipe de BESSY II a maintenant approfondi cette question. Le groupe dirigé par le professeur Alexander Föhlisch a systématiquement irradié des composés du complexe de fer en solution à l'aide de rayons X doux. Ils ont pu mesurer la quantité d'énergie de cette lumière absorbée par les molécules à l'aide d'une méthode appelée diffusion inélastique résonante des rayons X, ou RIXS. Ils ont étudié des complexes dans lesquels l'atome de fer était entouré soit de molécules de bipyridine, soit de groupes cyan (CN), ainsi que des formes mixtes dans lesquelles le centre de fer est lié à un groupe bipyridine et quatre groupes cyan chacun.
Les membres de l'équipe ont travaillé par équipes pendant deux semaines afin d'obtenir les données nécessaires. Les mesures ont montré que les formes mixtes, qui n'avait guère fait l'objet d'une enquête jusqu'à présent, sont particulièrement intéressants :Dans le cas où le fer est entouré de trois molécules de bipyridine ou de six groupements cyan (CN), l'excitation optique ne conduit qu'à une libération à court terme des porteurs de charge, ou à aucun. La situation ne change que lorsque deux des groupes cyano sont remplacés par une molécule de bipyridine. "Ensuite, nous pouvons voir avec l'excitation des rayons X doux comment les orbitales 3d du fer se délocalisent sur les groupes cyan, tandis qu'en même temps la molécule de bipyridine peut prendre le porteur de charge, " explique Raphaël Jay, premier auteur de l'étude et dont le travail de doctorat est dans ce domaine.
Les résultats montrent que des complexes de métaux de transition peu coûteux pourraient également convenir à une utilisation dans les cellules solaires, s'ils sont entourés de groupes de molécules appropriés. Il y a donc encore ici un champ riche pour le développement des matériaux.