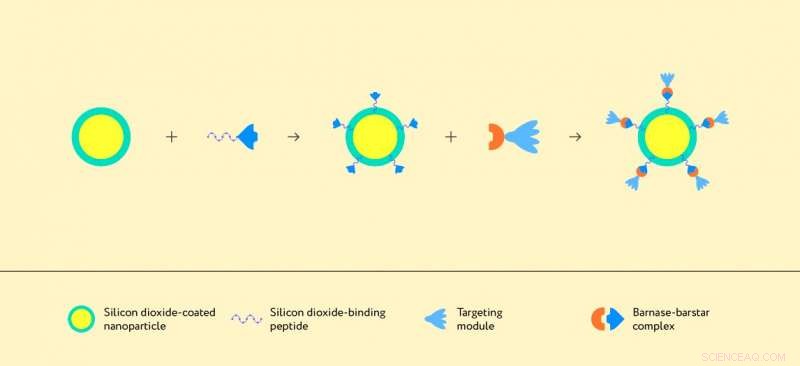
Illustration de l'assemblage de la structure à base d'une nanoparticule et du complexe protéique barnase-barstar. Crédit :Auteurs de l'article et Lion_on_helium, MIPT
Des biophysiciens ont mis au point une méthode pour modifier la surface des micro et nanoparticules, de minuscules structures mesurant entre un millième et un millionième de millimètre, en les recouvrant de molécules biologiques. Conçu de cette manière, les particules peuvent servir à la fois d'agents thérapeutiques et diagnostiques, administrer des médicaments aux cellules cancéreuses.
L'article a été publié dans la revue Matériaux et interfaces appliqués ACS . Ses auteurs sont des chercheurs de l'Institut de physique et de technologie de Moscou (MIPT), l'Institut de chimie bioorganique de l'Académie des sciences de Russie (IBCh RAS), Université Nationale de Recherche Nucléaire MEPhI, Université Sechenov, et l'Université Macquarie (Australie).
Vers 1900, Paul Ehrlich, le lauréat du prix Nobel de physiologie ou médecine 1908, envisagé des médicaments qui auraient un composant qui reconnaît les agents pathogènes dans le corps et un autre composant qui agit sur la cible. D'habitude, ces médicaments ciblent des récepteurs à la surface des cellules endommagées. Ces récepteurs permettent également à l'agent de reconnaître la cellule. Un tel système universel peut être utilisé pour le diagnostic, thérapie, ou les deux. Lorsque la thérapie et le diagnostic sont combinés, c'est ce qu'on appelle la théranostique.
Réaliser un système intégrant une composante thérapeutique et une composante diagnostique, une "colle moléculaire" est nécessaire pour maintenir les deux parties ensemble. Cette colle peut être réalisée sous forme de protéines capables de former un complexe stable en se liant les unes aux autres. L'un des complexes les plus stables de ce type est la paire de protéines barnase-barstar. Il existe une valeur connue sous le nom de constante de liaison qui caractérise la force de couplage des molécules d'un complexe. La constante de liaison du complexe barnase-barstar est 1, 000 à 1 million de fois supérieures à celles des complexes antigène-anticorps, qui sont à la base de notre réponse immunitaire.
Barnase et barstar peuvent être utilisés pour concevoir divers modules fonctionnels pour la théranostique. Par exemple, la barnase peut être liée à des agents thérapeutiques - anticorps, médicaments, molécules fluorescentes, etc. - tandis que barstar peut être fusionné avec un agent de ciblage. Ce concept a été suggéré par Sergey Deyev, le chef du laboratoire d'immunologie moléculaire de l'IBCh RAS. Les deux modules sont ensuite combinés, former un composé bifonctionnel, qui a des propriétés thérapeutiques et diagnostiques, et permet l'administration ciblée de médicaments. En fusionnant barnase et barstar avec diverses molécules thérapeutiques et diagnostiques, les chercheurs peuvent développer une gamme d'agents théranostiques basés sur le même principe. Ces structures moléculaires peuvent être portées à la surface de nano- ou microparticules. Les particules elles-mêmes peuvent avoir des propriétés auxiliaires, y compris la fluorescence ou la capacité d'être détruit lorsqu'il est exposé à un rayonnement, tuer les cellules nocives environnantes, comme les cellules cancéreuses. Des dizaines de structures moléculaires de différents types peuvent être déposées sur une minuscule particule, augmentant potentiellement ses effets thérapeutiques.

Illustration du principe de fonctionnement de la structure théranostique. Crédit :Auteurs de l'article et Lion_on_helium, MIPT
Kit d'assemblage moléculaire
La notion d'utilisation de nano- et microparticules pour délivrer des médicaments fait l'objet de recherches actives dans de nombreux laboratoires. Les chercheurs russes et australiens ont développé un agent théranostique à base de nanoparticules utilisant le complexe protéique barnase-barstar et étudié ses propriétés.
"La plupart des méthodes actuellement utilisées pour coupler chimiquement des biomolécules à des nanoparticules présentent de sérieux défauts, " dit l'auteur principal Victoria Shipunova, chercheur au laboratoire de nanobiotechnologie du MIPT et chercheur principal au laboratoire d'immunologie moléculaire de l'Institut de chimie bioorganique. "L'orientation spatiale des biomolécules est mal contrôlée, et ils rencontrent des problèmes lorsqu'ils se lient à leurs cibles. La densité des molécules couplées est assez faible, et la procédure prend du temps."
« Nous avons développé une méthode basée sur la paire de protéines barnase-barstar qui n'altère pas la structure spatiale des molécules de ciblage. Deux autres avantages sont sa haute spécificité et son couplage rapide :il ne faut que quelques minutes pour que tous les modules se fixent, " elle explique.
Les chercheurs ont utilisé des particules recouvertes de dioxyde de silicium comme vecteurs de leur complexe moléculaire. Les principales cibles des biostructures décrites dans l'article sont les cellules cancéreuses, identifiables par l'oncomarqueur HER2/neu à leur surface, montré comme une excroissance rouge dans la figure 2. HER2/neu est une protéine responsable de la croissance et de la division cellulaire et présente dans les cellules saines. Dans les cellules cancéreuses, cependant, cette protéine est en excès - ou surexprimée - leur permettant de croître et de se diviser de manière incontrôlable.
Les chercheurs ont utilisé une molécule de la classe des protéines à répétition ankyrine conçues, ou DARPins, comme agent de ciblage reconnaissant la protéine HER2/neu. Montré comme des structures en forme de campanule bleu clair dans les figures 1 et 2, Les DARPins sont de petites protéines hautement stables capables de se lier sélectivement à la molécule cible. Outre une molécule DARPin, qui reconnaît les cellules cancéreuses, la structure doit incorporer une molécule capable de se lier à la surface de la particule porteuse, c'est-à-dire au dioxyde de silicium. Pour ça, les chercheurs ont utilisé un peptide de liaison au dioxyde de silicium obtenu par conception rationnelle à l'Université Macquarie. Par conséquent, ils ont créé la structure suivante :une nano- ou microparticule est recouverte de dioxyde de silicium, auquel le module barnase-DARPin est attaché via le peptide de liaison au dioxyde de silicium fusionné avec barstar (figure 1). Surtout, chacun des éléments impliqués peut être modifié voire remplacé, modifier les propriétés de la structure globale. Dans un sens, il est similaire à un kit moléculaire de blocs de construction, qui peut être assemblé de plusieurs manières, produire différents agents thérapeutiques.
En effet, les chercheurs ont créé une méthode d'assemblage universelle, qui permet de combiner facilement de nombreuses molécules à potentiel thérapeutique et diagnostique, tout en préservant leur structure spatiale et leurs propriétés.