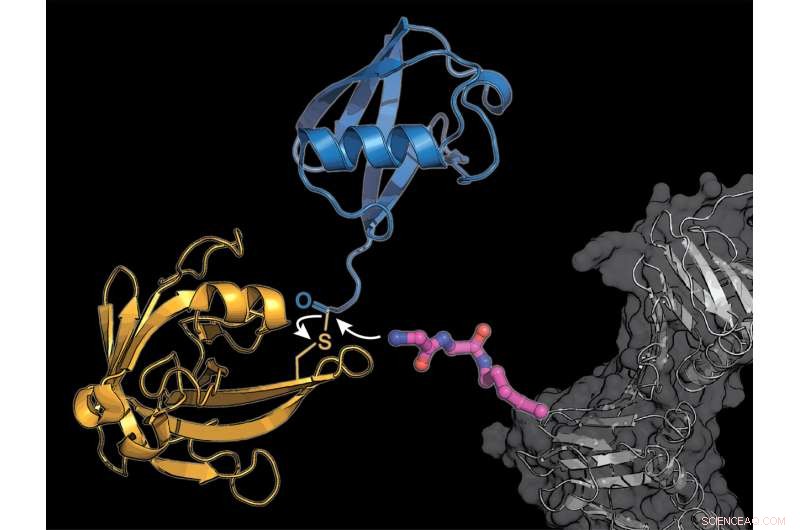
Les chercheurs ont équipé une protéine cellulaire (gris) d'un bloc de construction d'acide aminé lysine modifié (rose), à laquelle l'enzyme bactérienne sortase (jaune) transmet une molécule d'ubiquitine (bleu). Crédit :K. Lang / TUM
Les cellules humaines ont un système de régulation sophistiqué qui consiste à marquer les protéines avec la petite molécule d'ubiquitine. Dans un premier, une équipe de l'Université technique de Munich (TUM) a réussi à marquer des protéines avec de l'ubiquitine de manière ciblée dans des tubes à essai ainsi que dans des cellules vivantes. La procédure ouvre la porte à l'exploration du fonctionnement interne de ce système de réglementation vital.
Les plantes, champignons, les animaux et les humains expriment la protéine ubiquitine. Il comprend une séquence de 76 acides aminés, ce qui en fait une biomolécule relativement petite. Mais son influence est considérable :le type, la position et le nombre de molécules d'ubiquitine liées aux protéines déterminent leur stabilité, fonction, et l'emplacement dans la cellule.
« Pratiquement chaque processus dans la cellule est directement ou indirectement affecté par l'ubiquitine. C'est pourquoi les dysfonctionnements de ce mécanisme de marquage sont associés au développement et à la progression du cancer et de nombreuses autres maladies graves, " explique Kathrin Lang, Professeur de biochimie synthétique à l'Université technique de Munich.
La découverte du rôle important que joue ce système de régulation cellulaire dans la dégradation contrôlée des protéines a été récompensée en 2004 par le prix Nobel de chimie. Mais, dans de nombreux cas, les détails de la façon dont les modifications de l'ubiquitine affectent la fonction des cellules restent flous. L'équipe de Kathrin Lang a maintenant développé une méthode pour attacher des marqueurs d'ubiquitine aux protéines ciblées, une clé pour explorer le système.
Une enzyme bactérienne crée de nouveaux composés
L'équipe de Lang utilise deux astuces pour contourner le système naturel compliqué :elles incorporent un nouvel acide aminé modifié, à laquelle l'enzyme sortase dérivée des bactéries peut attacher l'ubiquitine ou une molécule similaire à l'ubiquitine.

Premier auteur Maximilian Fottner et Prof. Kathrin Lang dans leur laboratoire. Crédit :Andreas Battenberg / TUM
"Le plus grand défi était d'aligner les différentes étapes - l'incorporation de l'acide aminé non naturel dans une protéine cible et le transfert de l'ubiquitine par l'enzyme sortase - de manière à ce qu'elles fonctionnent non seulement dans le tube à essai mais aussi dans la vie cellules, " rappelle Maximilian Fottner, l'auteur principal de l'étude.
En attendant, les chercheurs de l'Université technique de Munich ont optimisé et breveté leur nouvelle méthode pour de nombreuses protéines cellulaires différentes. « Nous avons déjà noué des collaborations avec des médecins et des biologistes cellulaires qui souhaitent désormais travailler avec nous pour étudier les effets des marqueurs de l'ubiquitine sur le développement du cancer et des maladies neurodégénératives comme la maladie de Parkinson au niveau moléculaire, " dit le professeur Lang.