Crédit :Synthelis / Illusciencia
Le virus de l'hépatite C (VHC) est un virus transmissible par le sang qui provoque des maladies du foie et le cancer, avec plus de 300, 000 personnes meurent chaque année et 71 millions de personnes vivent avec une infection chronique dans le monde. Alors que les médicaments antiviraux sont actuellement utilisés, il n'y a pas de vaccination actuellement disponible et les effets secondaires peuvent entraîner un mauvais diagnostic.
Dans la recherche de nouvelles thérapies contre le VHC, les chercheurs se sont penchés sur la protéine membranaire p7, qui joue un rôle clé dans la libération du virus, pour les réponses. Cependant, il y a peu de données disponibles, et la structure cristallographique de la protéine n'a pas encore été résolue.
Des recherches récentes utilisant des neutrons ont conduit au développement d'une nouvelle méthode pour étudier l'intégration et la structure de la protéine dans un environnement membranaire biologique natif. Une collaboration entre Synthelis SAS, Université Grenoble Alpes, et l'Institut Laue-Langevin (ILL) ont permis aux chercheurs d'observer pour la première fois la structure d'un complexe protéique p7 fonctionnel du VHC au sein d'une bicouche lipidique physiologiquement pertinente, à une résolution nanométrique.
Pour faire ça, les scientifiques ont réalisé une réflectométrie neutronique (NR) sur FIGARO, un réflectomètre de temps de vol au centre phare mondial de la science neutronique, ILL à Grenoble, La France. Plages de transfert d'impulsion de 0,008> qz> 0,2 Å-1 et les réflectivités minimales de R ~ 5x10-7 ont été mesurées en utilisant des longueurs d'onde λ =2-20 Å, deux angles d'incidence et une résolution dqz/qz de 10 %.
Les Rapports scientifiques sur la nature étude a révélé que la protéine p7 du VHC s'assemble dans la membrane lipidique en oligomères qui prennent la forme d'un entonnoir. La forme conique indique une orientation préférée des protéines, révélant un mécanisme d'insertion protéique spécifique, et aider à définir les mécanismes cibles potentiels pour le développement futur de médicaments.
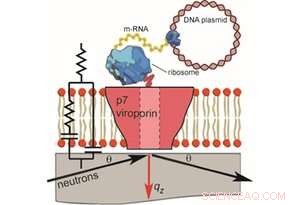
Figure 1. La préparation sans cellules des bicouches prises en charge contenant des mesures p7 et NR et EIS (pas à l'échelle). Pour la réflectivité des neutrons, des membranes se sont formées sur du quartz et un faisceau de neutrons incident a été transmis à travers le substrat et réfléchi par Crédit :Thomas Soranzo (Synthelis SAS, Université Grenoble Alpes), Donald K. Martin (Université Grenoble Alpes), Jean-Luc Lenormand (Université Grenoble Alpes), et Erik B. Watkins (Laboratoire national de Los Alamos)
Comme le dysfonctionnement des protéines membranaires est également corrélé à un large éventail de maladies, cette avancée dans les méthodes d'analyse des protéines membranaires dans leur état natif, à l'échelle atomique, a également le potentiel d'aider à soutenir de nouvelles approches thérapeutiques dans d'autres domaines, comme pour le développement d'anticorps contre le VIH.
Erik Watkins, ancien scientifique instrumentiste de l'ILL FIGARO, a déclaré :"Cette nouvelle approche est une méthode simple et efficace complémentaire à d'autres techniques structurelles et plus complexes telles que la RMN et la cristallographie. Cela s'est avéré un outil puissant pour caractériser la conformation de la protéine dans son environnement naturel et que nous pouvons envisager d'utiliser pour la membrane découvertes de protéines non seulement dans les progrès du VHC, mais plus loin aussi."
Bruno Tillier, Directeur général, Synthelis a ajouté :« Les neutrons se sont avérés une ressource clé pour ce projet car nous devions analyser la structure de la protéine p7 dans un environnement spécifique. Nous pouvons maintenant chercher à appliquer cette compréhension approfondie du virus non seulement aux appareils, comme les biocapteurs, mais aussi d'étudier le comportement des protéines membranaires dans les bicouches lipidiques vers d'autres domaines."
Donald Martin, Le directeur de l'équipe de recherche SyNaBi et professeur à l'Université Grenoble Alpes a également déclaré :« Ces nouveaux résultats sont de bon augure pour notre développement continu de nouveaux systèmes et dispositifs nanostructurés. La collaboration fructueuse en cours entre physiciens, biologistes et ingénieurs de ces institutions à Grenoble fournit la compréhension fondamentale importante des processus physiques et biologiques qui sous-tend le développement de tels systèmes et dispositifs nanostructurés. »
Thomas Soranzo, L'Université Grenoble Alpes et l'ancien scientifique de Synthelis ont également déclaré :« un goulot d'étranglement majeur dans l'analyse de la réflectivité des neutrons des protéines membranaires dans la bicouche planaire est l'insertion suffisante de polypeptides. Cette combinatoire, La nouvelle méthode permet non seulement une incorporation significative de matériel, mais permet également un étiquetage spécifique qui pourrait améliorer les études de structure/fonction des protéines membranaires."