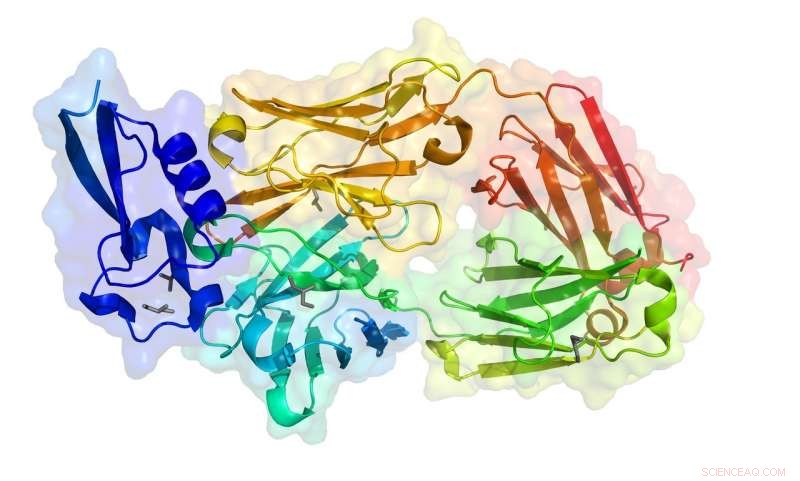
ID PDB :6B0S
La Source de lumière canadienne célèbre deux étapes franchies par des scientifiques qui ont mené des recherches à l'installation nationale de l'Université de la Saskatchewan.
Les scientifiques ont résolu 1, 000 structures protéiques à partir des données collectées sur les lignes CMCF de CLS. Ceux-ci ont été ajoutés à la Protein Data Bank - une collection de structures résolues par des chercheurs du monde entier. Les chercheurs ont également publié 500 articles scientifiques basés sur leurs travaux utilisant les lignes de lumière de cristallographie.
Les protéines sont les éléments constitutifs de la vie et sont décrites comme les chevaux de bataille du corps. Le corps est composé de milliards de cellules. Les cellules produisent des protéines, qui font le travail de briser la nourriture, envoyer des messages à d'autres cellules, et lutter contre les bactéries, virus et parasites. Les découvertes au CLS vont de la façon dont le parasite du paludisme envahit les globules rouges aux raisons pour lesquelles les superbactéries sont résistantes à certains antibiotiques et comment les mutations de la protéine parkin entraînent certains types de maladie de Parkinson. Comprendre comment ces protéines et d'autres fonctionnent peut potentiellement sauver des millions de vies.
« Chacune de ces structures protéiques qui ont été résolues au CLS représente une contribution significative au corpus mondial de connaissances dans les domaines de la biologie et de la biochimie, faire avancer la recherche en santé, ", déclare le PDG Rob Lamb.
« Nous sommes fiers de ces jalons, et le travail acharné et le dévouement qui ont été nécessaires pour les atteindre. Des scientifiques viennent de partout au Canada et du monde entier pour utiliser nos installations à la fine pointe de la technologie, soutenues par des scientifiques fantastiques. »
Grâce à la puissante lumière à rayons X du synchrotron, les scientifiques explorent l'humain, animal, plante, bactérien, les protéines virales et parasitaires ainsi que les acides nucléiques. Après avoir exposé un cristal de protéine à la lumière synchrotron, les scientifiques sont en mesure d'utiliser les informations pour produire un modèle 3D qui montre les positions des atomes. Ces informations structurelles fournissent des détails sur la façon dont les protéines fonctionnent et interagissent. Les scientifiques utilisent ensuite ces informations pour mieux comprendre la biologie, processus environnementaux, ainsi que la santé humaine et la maladie. Souvent, ils utilisent l'information pour développer de nouveaux produits pharmaceutiques.
« Ces lignes de lumière sont un énorme coup de pouce pour la communauté biologique structurelle canadienne, " dit Miroslaw Cygler, Professeur de biochimie à l'Université de la Saskatchewan et titulaire de la Chaire de recherche du Canada en médecine moléculaire utilisant la lumière synchrotron. Il est également le chef de l'équipe consultative de la ligne de lumière CMCF.
« Chaque laboratoire de cristallographie des protéines au Canada d'un océan à l'autre utilise cette installation pour faire des expériences. Le Canada est un grand pays. Voyager coûte très cher. Depuis le tout début, l'une des missions de l'établissement était de fournir un service à distance. C'est vraiment crucial en termes d'impact et d'importance pour les Canadiens, " dit Cygler.
Jean-Philippe Julien est tout à fait d'accord. Julien est titulaire de la Chaire de recherche du Canada en immunologie structurale et scientifique en médecine moléculaire à l'Institut de recherche du Hospital for Sick Children, ainsi qu'un professeur adjoint aux départements de biochimie et d'immunologie de l'Université de Toronto.
Au cours des deux dernières années, il a résolu 20 structures de protéines en utilisant la collecte de données à distance. Il envoie des échantillons de cristal à Saskatoon où les scientifiques de CLS l'aident à monter les échantillons sur la ligne de lumière, puis l'équipe de Julien utilise l'équipement depuis leur laboratoire de Toronto. La structure 6B0S (structure cristalline de la protéine circumsporozoïte aTSR en complexe avec l'anticorps 1710) est la millième de structure protéique résolue au CLS et fait partie des recherches de Julien pour développer un vaccin qui empêche le parasite du paludisme de provoquer des infections.
The World Health Organization reports that nearly half of the world's population is at risk of contracting malaria, with hundreds of thousands of children dying every year.
In collaboration with scientists in Germany, Julien's team examined B cells – a type of white blood cell – from volunteers who received a candidate malaria vaccine and were then exposed to the malaria parasite to evaluate protection in a clinical trial. By solving the protein structure of an antibody developed by one of the European volunteers in this study, Julien has learned more about how the vaccine interacted with their immune system. This provides scientists with further clues as to how to alter the vaccine to improve immunity to malaria.
"In characterizing human antibody responses to malaria antigens, it is critical to have access to a world-class synchrotron beamline within Canada, " says Julien.
"Recent upgrades to CMCF have tremendously increased the sensitivity and throughput of data collection, enabling us to solve more antigen-antibody structures informing our quest towards the design of improved malaria vaccine candidates."
Julien's research describing this latest protein structure was published this week in The Journal of Experimental Medicine .
More than 70 academic, government and industrial research groups from across Canada and the United States conduct research using the CMCF beamlines.
The number of depositions has been increasing every year and with upcoming upgrades on the beamlines, the volume of work is expected to continue to accelerate.
The 500th paper was the result of research by Cygler's laboratory at the U of S. Using crystallography as well as other techniques, the researchers have a better understanding of how iron-sulfur clusters are synthesized in the body. These clusters are key components of many proteins critical to life and defects in the formation of the clusters can cause severe neurological and metabolic diseases, often with fatal outcomes. Les résultats ont été publiés dans Communication Nature .