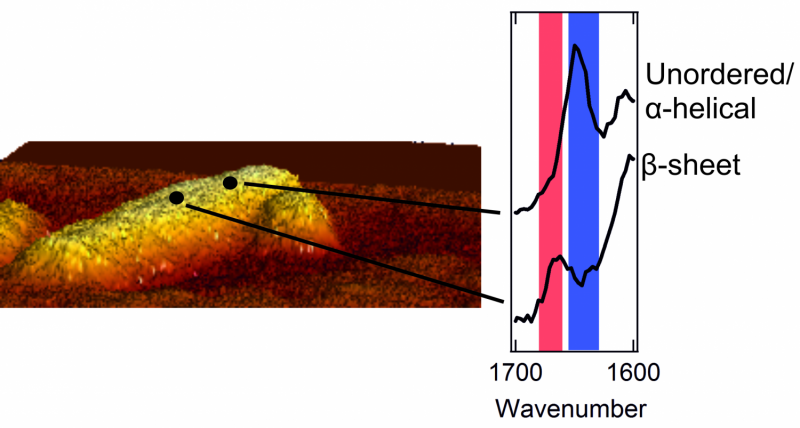
A gauche :une image au microscope à force atomique d'une fibrille de quelques nanomètres de diamètre. A droite :deux spectres qui montrent la structure extérieure. Un pic dans la zone rouge est caractéristique d'un patch avec une structure de feuille bêta bien ordonnée. Un pic dans la zone bleue est typique d'une zone chaotique, structure désordonnée.
Des chercheurs de l'institut FOM AMOLF ont, Pour la toute première fois, réussi à faire une image de la structure extérieure d'un agrégat de protéines qui provoque des maladies comme la maladie d'Alzheimer et le diabète de type 2. Ils ont découvert que la surface extérieure de ces agrégats est structurée de manière très désordonnée, contrairement à leurs intérieurs soigneusement agencés. Les chercheurs espèrent que leurs travaux permettront de mieux comprendre comment les agrégats endommagent les cellules voisines. Les résultats de la recherche ont été publiés en ligne dans la revue Petit le 7 mai, 2015.
Les agrégats de protéines étudiés par les chercheurs sont constitués de longs, protéines repliées. Les chercheurs connaissent depuis assez longtemps la structure interne de ces agrégats (anciennement appelés fibrilles amyloïdes). Cependant, avec les microscopes conventionnels, il restait toujours impossible de voir les structures protéiques à la surface extérieure des agrégats. En rétrospective, c'était comme si les chercheurs étaient enfermés dans une maison. Ils pourraient étudier à fond l'intérieur de la maison, mais tant qu'ils n'avaient pas la clé, ils étaient incapables de sortir et de regarder sa façade à l'extérieur. La percée est survenue lorsque les chercheurs ont conçu cette « clé » en combinant deux techniques différentes :la microscopie et la spectroscopie. Cela leur a permis d'étudier enfin la « maçonnerie » extérieure.
Désordonné
Une fois qu'ils ont pu apercevoir l'extérieur des agrégats de protéines, les chercheurs étaient surpris. L'intérieur des agrégats est strictement organisé. Les protéines sont soigneusement disposées dans une structure dite en feuillet bêta, qui forme une torsion, drap plissé. Cependant, ils ont constaté que l'extérieur de l'agrégat a une structure beaucoup plus désordonnée et chaotique. C'est-à-dire, les protéines extérieures forment un ensemble désorganisé, motif irrégulier. Ici et là, il existe des correctifs qui forment une structure de feuille bêta, mais dans d'autres endroits, cette régularité est introuvable. Les chercheurs ont même trouvé des différences structurelles d'un nanomètre à l'autre, sur une seule et même fibrille.
Les chercheurs ont également remarqué que la structure extérieure de chaque fibrille est très différente de la suivante. Une fibrille peut contenir de nombreux patchs avec une structure en feuillet bêta, tandis qu'un autre manque presque complètement de ces correctifs réguliers. De plus, les acides aminés qui peuvent être trouvés à l'extérieur diffèrent également pour chaque fibrille.
L'extérieur désordonné est en contact direct avec les membranes des cellules voisines. De cette façon, sa structure joue un rôle crucial dans l'endommagement de ces cellules. Ce type de dommages cellulaires est couramment observé chez les patients atteints de diabète de type 2 ou de la maladie d'Alzheimer.
La 'clé' qui a ouvert les portes
Les chercheurs de l'AMOLF ont collaboré avec leurs collègues de l'Université d'Utrecht, l'Institut Max Planck pour la recherche sur les polymères à Mayence, et le Leibniz Institute for Photonic Technology à Iéna pour développer une nouvelle façon de visualiser la structure protéique extérieure des agrégats. La clé s'est avérée être une combinaison de spectroscopie et de microscopie à force atomique.
Un microscope à force atomique se compose d'une pointe acérée (sonde) qui se déplace sur la surface d'un objet. Cela permet au microscope d'explorer une fibrille amyloïde à l'échelle atomique et de faire une carte en relief. Pendant ce temps, le spectromètre mesure le spectre dit Raman pour chaque pixel de la carte. Ces spectres renseignent sur la façon dont les protéines sont repliées, et la présence d'acides aminés spécifiques à la surface des agrégats. Les signaux mesurés par le spectromètre sont généralement faibles, mais une couche métallique sur la pointe du microscope les amplifie grandement.
Des images de l'extérieur des fibrilles amyloïdes avaient déjà été faites, mais l'équipe a maintenant imagé la façon dont les protéines étaient également repliées. Première auteure Corianne van den Akker :« En combinant la microscopie et la spectroscopie, nous avons réussi à relier chaque morceau de structure à un emplacement à l'extérieur de l'amyloïde. De cette façon, nous pourrions faire une image avec une résolution à l'échelle nanométrique, ainsi que de déterminer la structure à chaque emplacement. C'est l'exploit unique de la technique que nous avons utilisée."
L'étape suivante
Avec les connaissances nouvellement acquises, il sera également possible de mesurer la structure des amyloïdes qui se sont formées à l'extérieur des cellules vivantes. La technique peut également être utilisée pour tester des médicaments qui visent à prévenir ou à dissoudre les agrégats de protéines.