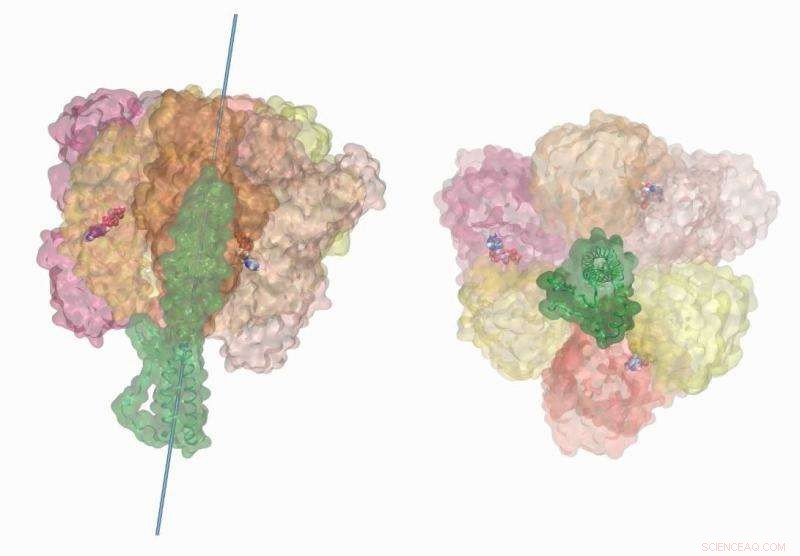
La rotation induite par l'hydrolyse de l'ATP de la tige centrale dans l'ATP synthase de type V de la bactérie Enterococcus hirae illustre le couplage chimio-mécanique du moteur moléculaire. Ces simulations ont été réalisées sur le supercalculateur Titan en utilisant NAMD2.12. La visualisation et le rendu vidéo ont été terminés sur VMD1.9.3. Crédit :Barry Isralewitz, Université de l'Illinois à Urbana-Champaign
Malgré la grande diversité des organismes vivants, la molécule utilisée pour stocker et transmettre l'énergie au sein de l'aérobie, ou utilisant de l'oxygène, cellules est remarquablement le même. Des bactéries aux champignons, les plantes, et animaux, l'adénosine triphosphate (ATP) sert de monnaie énergétique universelle de la vie, alimenter les processus dont les cellules ont besoin pour survivre et fonctionner.
Au cours d'une journée, un individu utilisera généralement l'équivalent de son poids corporel en ATP ; cependant, le corps humain ne transporte qu'une petite quantité de la molécule à un moment donné. Cela signifie que les cellules doivent constamment recycler ou reconstituer leur capacité limitée, s'appuyant sur un moteur moléculaire très efficace appelé ATP synthase pour faire le travail.
Dans le cadre d'un projet dédié à la modélisation de la façon dont les bactéries violettes unicellulaires transforment la lumière en nourriture, une équipe de scientifiques en informatique de l'Université de l'Illinois à Urbana-Champaign (UIUC) a simulé une ATP synthase complète dans le détail de tous les atomes. Le travail s'appuie sur la première phase du projet – un organite photosynthétique de 100 millions d'atomes appelé chromatophore – et donne aux scientifiques un aperçu sans précédent d'une machine biologique dont l'efficacité énergétique dépasse de loin celle de tout système artificiel.
D'abord proposé sous la direction de feu Klaus Schulten, un pionnier dans le domaine de la biophysique computationnelle et le fondateur du groupe de biophysique théorique et computationnelle à l'UIUC, la recherche a progressé sous la direction d'Abhishek Singharoy, co-chercheur principal et boursier postdoctoral de la National Science Foundation avec le Center for the Physics of Living Cells de l'UIUC.
En plus de Singharoy, l'équipe comprend des membres des groupes de professeurs de l'UIUC Emad Tajkhorshid, Zaida Luthey-Schulten et Aleksei Aksimentiev; chercheur scientifique Melih Sener; et les développeurs Barry Isralewitz, Jim Phillips, et John Stone. Le collaborateur expérimental Neil Hunter de l'Université de Sheffield en Angleterre a également participé au projet.
L'équipe dirigée par l'UIUC a construit et testé son méga-modèle dans le cadre d'une allocation pluriannuelle attribuée dans le cadre du programme Innovative and Novel Computational Impact on Theory and Experiment sur le supercalculateur Titan, un Cray XK7 géré par Oak Ridge Leadership Computing Facility (OLCF) du département américain de l'Énergie (DOE), une installation d'utilisateurs du DOE Office of Science située au Oak Ridge National Laboratory du DOE.
En utilisant Titan, l'équipe a produit un outil virtuel qui peut prédire avec précision la production d'énergie chimique d'un système photosynthétique en fonction de la quantité de lumière solaire absorbée. La recherche pourrait un jour contribuer à une technologie avancée d'énergie propre qui intègre des concepts biologiques.
"La nature a conçu le chromatophore de telle sorte qu'il puisse générer suffisamment d'ATP pour que ces bactéries survivent dans des environnements à faible luminosité tels que le fond des étangs et des lacs, " a déclaré Singharoy. "Notre travail a capturé ce processus de conversion d'énergie dans le détail de tous les atomes et nous a permis de prédire son efficacité."
Lumière en mouvement
Souvent appelée la centrale électrique de la cellule, L'ATP synthase est une enzyme complexe qui accélère la synthèse de ses précurseurs moléculaires, adénosine diphosphate (ADP) et phosphate. Intégré dans la membrane interne et externe du chromatophore, le moteur enzymatique se compose de trois parties principales :un rotor alimenté par des ions, une tige centrale, et un anneau protéique.
Semblable à une roue hydraulique qui est tournée par la force d'un ruisseau qui coule, le rotor de l'ATP synthase exploite le mouvement électrochimiquement stimulé des ions, comme les protons ou le sodium, d'une concentration élevée à une faible concentration à travers la membrane. L'énergie mécanique résultante est transférée à la tige centrale, qui aide l'anneau protéique à synthétiser l'ATP.
Remarquablement, le processus fonctionne aussi bien à l'envers. Lorsque trop d'ions s'accumulent sur la face externe du chromatophore, l'anneau protéique de l'ATP synthase décomposera l'ATP en ADP, un processus appelé hydrolyse, et les ions reflueront vers l'intérieur.
"Normalement, vous vous attendriez à beaucoup de perte d'énergie pendant ce processus, comme dans n'importe quel moteur artificiel, mais il s'avère que l'ATP synthase a très peu de déchets, " Singharoy a déclaré. " Comment ce moteur est conçu pour minimiser les pertes d'énergie est la question que nous avons commencé à poser. "
Semblable à un bricoleur qui démonte un moteur pour mieux comprendre son fonctionnement, L'équipe de Singharoy a cassé le 300, enzyme de 000 atomes dans ses éléments constitutifs. S'appuyant sur des décennies de recherche sur l'ATP synthase, modèles passés, et de nouvelles données expérimentales fournies par une équipe japonaise dirigée par Takeshi Murata du RIKEN Center for Life Science Technologies, l'équipe a construit et simulé les pièces du puzzle de l'ATP synthase indépendamment et ensemble sur Titan.
Pour capturer les processus importants qui se déroulent sur des échelles de temps de la milliseconde, Singharoy, en collaboration avec Christophe Chipot du Centre National de la Recherche Scientifique et Mahmoud Moradi de l'Université de l'Arkansas, déployé stratégiquement le code de dynamique moléculaire NAMD. L'équipe a exécuté une stratégie d'ensemble, suivi du mouvement d'environ 1, 000 répliques d'ATP synthase simultanément avec des pas de temps de 2 femtosecondes, ou 2, 000 trillionièmes de seconde. Au total, l'équipe a accumulé 65 microsecondes (65 millionièmes de seconde) de temps de simulation, utiliser ces informations pour extrapoler les mouvements qui se produisent au cours d'une milliseconde (1 millième de seconde).
Par conséquent, l'équipe a identifié des mouvements de pivotement non documentés auparavant dans l'anneau protéique qui aident à expliquer l'efficacité du moteur moléculaire. De la même manière, les simulations de l'équipe ont capturé l'élasticité de type élastique de la tige centrale de l'enzyme. L'équipe de Singharoy a estimé que lorsqu'elle est associée à l'anneau protéique, la tige absorbe environ 75 pour cent de l'énergie libérée lors de l'hydrolyse.
En outre, les simulations de l'anneau protéique lui-même ont révélé une unité qui peut fonctionner indépendamment, une découverte rapportée dans les expériences mais pas dans les détails informatiques. "Même en l'absence de la tige centrale, l'anneau protéique lui-même est capable d'hydrolyse de l'ATP. C'est pas très efficace, mais il a la capacité, " a déclaré Singharoy.
La grande image
Après avoir simulé son modèle complet d'ATP synthase, l'équipe de l'UIUC a incorporé l'enzyme dans son modèle de chromatophore précédemment construit pour obtenir l'image la plus complète d'un système photosynthétique à ce jour.
Avec ce panneau solaire biologique virtuel, l'équipe a pu mesurer chaque étape du processus de conversion d'énergie - de la récolte de la lumière, au transfert d'électrons et de protons, à la synthèse d'ATP et mieux comprendre ses fondements mécaniques.
Le chromatophore de la nature est conçu pour une faible intensité lumineuse, n'absorbant qu'entre 3 et 5 pour cent de la lumière du soleil au cours d'une journée typique. L'équipe, grâce aux efforts de Sener, trouvé que ce taux d'absorption se traduit par environ 300 ATP par seconde, c'est la quantité dont une bactérie a besoin pour rester en vie.
Ayant étudié la conception de la nature, l'équipe voulait maintenant voir si elle pouvait l'améliorer. En supposant la même intensité lumineuse, l'équipe a conçu un chromatophore artificiel avec une composition protéique résolument non naturelle, augmentant la présence de deux types de protéines spécialisées. L'analyse de la nouvelle conception a prédit un triplement de la production d'ATP du système photosynthétique, ouvrant la possibilité d'une optimisation guidée par l'homme du chromatophore.
"Vous pourriez potentiellement modifier génétiquement un chromatophore ou changer sa concentration en protéines, " a déclaré Singharoy. "Ces prédictions promettent d'apporter de nouveaux développements dans la photosynthèse artificielle."
Dans le cadre de sa dernière allocation INCITE, l'équipe de l'UIUC s'oriente vers la conversion d'énergie dans une forme de vie différente :les animaux. Prenant ce qu'il a appris de la modélisation de la photosynthèse chez les bactéries violettes, l'équipe modélise la respiration cellulaire, le processus utilisé par les cellules animales pour convertir les nutriments en ATP.
"Vous avez au moins deux protéines en commun entre la respiration et la photosynthèse, " dit Singharoy, qui poursuit son implication dans le projet en tant que professeur assistant à l'Arizona State University. « La question est de savoir quels principes de conception se transmettent aux organismes supérieurs ? »
La vie sur place
La simulation du chromatophore - complète avec l'ATP synthase - marque un changement en cours dans la biophysique computationnelle par rapport à l'analyse de parties cellulaires individuelles (par exemple, protéines uniques et des centaines d'atomes) à l'analyse de systèmes cellulaires entiers (par exemple, des centaines de protéines et des millions d'atomes).
Schulten, décédé en octobre 2016, compris mieux que la plupart des gens l'importance d'utiliser des ordinateurs pour simuler la nature. Dans une interview en 2015, il a exposé sa justification pour la modélisation du chromatophore. "La motivation est de comprendre une étape très clé de la vie sur Terre dont dépend toute vie aujourd'hui. En termes d'énergie, 95% de la vie sur Terre dépend de la photosynthèse, y compris les humains, " il a dit.
Schulten a également compris le jalon qu'un organite spécialisé représentait sur la voie de la simulation d'un organisme unicellulaire complet. "Nous n'avons rien de plus petit qu'une cellule que nous appellerions vivante, " dit-il. " C'est la plus petite entité vivante, et nous voulons le comprendre."
Avec les supercalculateurs de nouvelle génération, dont le Sommet de l'OLCF, mise en ligne en 2018, le groupe de recherche Schulten fondé en 1989 s'apprête à relever le grand défi de la simulation d'une cellule.
Sous la direction de Tajkhorshid, l'équipe prévoit de simuler la première cellule d'un milliard d'atomes, y compris les composants de base dont une cellule a besoin pour survivre et se développer. Les améliorations apportées au NAMD et les travaux réalisés dans le cadre du programme Center for Accelerated Application Readiness de l'OLCF contribuent à faire de la vision de Schulten et d'autres une réalité.
"Nous continuons d'avancer, " a déclaré Singharoy. "Notre étude exhaustive d'un organite complet dans les détails de tous les atomes a ouvert la porte à une cellule complète dans les détails de tous les atomes."