Les chercheurs utilisent des rayons X puissants pour révéler les structures moléculaires sur le site où les composés médicamenteux interagissent avec les récepteurs cellulaires. Ces structures aident à ouvrir la voie à la conception des médicaments du futur. Crédit :Greg Stewart/SLAC National Accelerator Laboratory
Les chercheurs espèrent concevoir une nouvelle génération de médicaments contre un éventail de maladies mortelles. La tâche, cependant, est coûteux, pénible et souvent inefficace. L'un des principaux défis est de comprendre une classe particulière de protéines qui ornent les surfaces cellulaires, qui sont les cibles de la majorité des médicaments pharmaceutiques.
Maintenant, Wei Liu et ses collègues du Biodesign Institute de l'ASU, avec une équipe dirigée par Haitao Zhang et Vadim Cherezov de l'USC ont examiné une cible médicamenteuse prometteuse avec des détails lumineux, à l'aide d'un appareil appelé laser à électrons libres à rayons X, ou XFEL.
leurs résultats, qui apparaissent dans l'édition avancée en ligne de la revue La nature , apporter un éclairage nouveau sur l'AT2R, un récepteur cellulaire critique, dont les chercheurs ont seulement commencé à découvrir l'éventail des fonctions. Les découvertes du groupe pourraient accélérer le développement de nouveaux composés traitant les maladies cardiovasculaires, douleur neuropathique et croissance des tissus.
L'AT2R appartient à une famille de récepteurs cellulaires appelés GPCR (pour G-protein couplé receptor), la plus grande famille de récepteurs membranaires cellulaires dans le génome humain. Comme l'explique Liu, Les GPCR sont des candidats attractifs pour le ciblage par de nouveaux médicaments car ils fournissent des lignes de communication essentielles entre l'environnement externe d'une cellule et son fonctionnement interne.
"Les humains ont plus de 800 GPCR, " Liu dit " et chacun d'eux est important, car ils reconnaissent des milliers d'entités différentes de l'extérieur de la cellule, y compris les petites molécules, peptides, protéines et même des photons. » La rhodopsine GPCR sensible à la lumière, par exemple, est essentiel pour la vision, les récepteurs olfactifs rendent compte de l'odorat, tandis que la caféine du café agit en se liant aux récepteurs de l'adénosine, et ainsi de suite.
En plus de leurs rôles essentiels d'entretien ménager, Les GPCR fournissent des cibles médicamenteuses pour le traitement d'une myriade de maladies humaines. "Pour presque toutes les maladies contre lesquelles nous luttons, Les protéines GPCR pourraient être les cibles potentielles des médicaments :récepteurs de chimiokines pour le VIH, récepteurs de la sérotonine pour la maladie d'Alzheimer, récepteurs dopaminergiques pour la toxicomanie et la maladie de Parkinson, " dit Liu.

La station expérimentale d'imagerie à rayons X cohérente (CXI) du laser à rayons X Linac Coherent Light Source (LCLS) du SLAC est spécialement équipée pour étudier les protéines cristallisées en détail à l'échelle atomique. Cette station a été utilisée dans une étude du récepteur AT2 de l'angiotensine II lié à un composé médicamenteux. Crédit :SLAC National Accelerator Laboratory
En utilisant les puissants rayons X de la source de lumière cohérente Linac (LCLS) du SLAC et de la source de photons avancée (APS) du Laboratoire national d'Argonne, les scientifiques ont découvert de nouveaux détails structurels du récepteur de l'angiotensine II AT2R qui ont intrigué les chercheurs pendant deux décennies. AT2R est l'un des deux récepteurs de l'angiotensine II, et sa paire, AT1R, a été utilisé avec succès comme cible pour les médicaments contre l'hypertension.
Les informations révélées par l'étude pourraient donner aux développeurs de médicaments une nouvelle voie pour des composés qui combattent la douleur et l'inflammation ou favorisent la régénération des tissus en s'amarrant confortablement dans une poche de la forme tridimensionnelle élaborée d'AT2R.
"Contrairement à son frère AT1R, le récepteur AT2 n'a pas été entièrement compris, " dit Cherezov, professeur de chimie à l'Université de Californie du Sud et chercheur principal de l'étude. "Grâce à cette étude, nous avons découvert de nombreux détails importants sur la structure du récepteur AT2 et la façon dont il se lie aux composés chimiques, des informations qui stimuleront d'autres études sur la fonction du récepteur et pourraient permettre une prochaine étape passionnante dans la découverte de médicaments. »
Deux récepteurs, De nombreux mystères
Les deux récepteurs de l'angiotensine II, AT1 et AT2, sont des éléments clés d'un système hormonal qui aide à réguler la pression artérielle et les niveaux de sodium dans le sang. Elles sont appelées "protéines membranaires" car elles chevauchent les membranes plasmiques des cellules, où ils reçoivent des signaux d'hormones à l'extérieur de la cellule et les transmettent à des partenaires solubles à l'intérieur de la cellule, telles que les protéines G ou les β-arrestines, déclencher une cascade d'événements qui diffusent le signal dans toute la cellule.
De nombreux médicaments contre l'hypertension actuellement sur le marché ciblent le récepteur AT1 en raison de son rôle bien compris dans la régulation de la pression artérielle; ils bloquent AT1 afin de réduire la pression artérielle. Le récepteur AT2, d'autre part, est encore une cible médicamenteuse insaisissable malgré de multiples études sur sa fonction. Certains, mais pas tout, ont montré qu'il contrecarre les effets de l'AT1; d'autres soulignent son potentiel de protection et de régénération des tissus; et d'autres encore suggèrent qu'il pourrait jouer un rôle dans le blocage de la douleur.
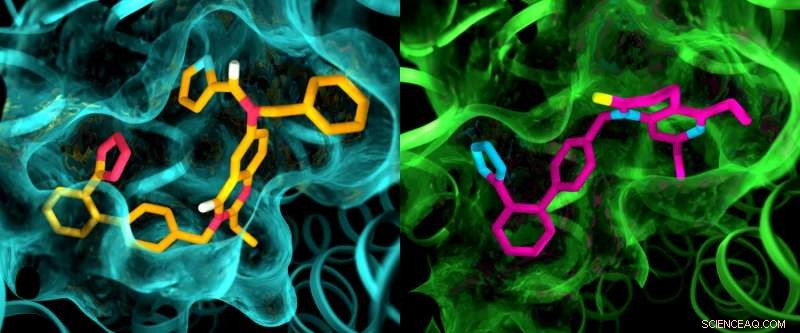
Bien que les deux récepteurs de l'angiotensine II soient considérés comme très similaires, une étude aux rayons X a montré des différences claires dans les poches où les récepteurs se lient aux composés de type médicament. Cette illustration montre des détails dans les structures de poche d'AT2 (à gauche) et d'AT1 (à droite). Crédit :Greg Stewart/SLAC National Accelerator Laboratory
Bien qu'il n'y ait pas encore de médicaments approuvés qui agissent sur les récepteurs AT2, les sociétés pharmaceutiques recherchent agressivement des composés qui les activeront ou les bloqueront. Un tel composé, appelé EMA401, est testé chez des patients pour le traitement de la douleur neuropathique.
La dernière étude répond à deux objectifs :comprendre en quoi AT2 diffère de AT1, afin de le cibler sélectivement; et explorer pourquoi AT2 - qui possède toutes les caractéristiques classiques d'un GPCR, tout comme AT1 - ne parvient pas à activer les protéines G, qui diffusent des signaux à l'intérieur des cellules, ou interagir avec l'arrestine, désactiver ces signaux.
Biologie sous la lumière des rayons X
Dans les expériences, les chercheurs ont examiné deux types d'échantillons différents, qui ont été transformés en cristaux pour examen aux rayons X. Dans une, le récepteur AT2 était lié à un composé sélectif, celui qui se lie uniquement à AT2. Ces cristaux étaient si petits qu'ils ne pouvaient être étudiés qu'au laser à rayons X à électrons libres LCLS du SLAC, où ils ont été diffusés à travers un faisceau d'impulsions de rayons X ultrarapides.
Dans l'autre, un composé non sélectif était lié à la fois à AT1 et à AT2. Ces échantillons, qui a formé des cristaux plus gros, ont été sondés à la source lumineuse synchrotron APS d'Argonne.
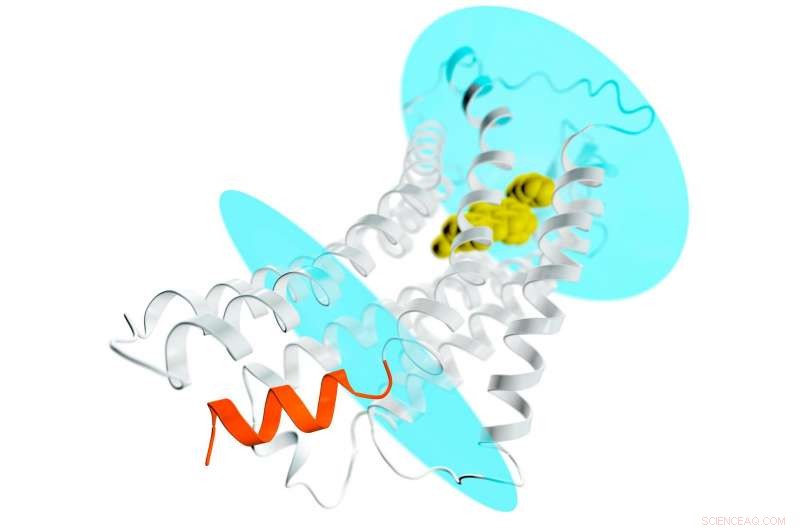
Une représentation du récepteur AT2 (spirales et filaments gris) s'étendant à travers une membrane cellulaire ; les ovales bleus représentent les surfaces interne et externe de la membrane. Un composé médicamenteux potentiel est lié dans la poche extérieure du récepteur (jaune) stabilisant le récepteur dans une conformation de type actif. Cela conduirait normalement à l'activation des protéines G et à la propagation d'un signal dans toute la cellule. Mais dans le cas d'AT2, l'endroit où les protéines G s'arriment pour recevoir le signal est bloqué par une hélice en forme de spirale (orange) qui fait partie du récepteur. Ce nouveau détail permet d'expliquer pourquoi les récepteurs AT2 ne se lient pas et n'activent pas les protéines G, mais à la place, ils transmettent probablement le signal à l'intérieur de la cellule via d'autres mécanismes encore inconnus. Crédit :Greg Stewart/SLAC National Accelerator Laboratory
Résultats inattendus
Les résultats des expériences ont été surprenants à plusieurs égards. D'abord, bien que les deux composés aient été conçus pour bloquer et désactiver les récepteurs, ils ont laissé AT2 dans un état qui semblait être actif. En outre, bien que AT1 et AT2 aient été considérés comme très similaires, les poches où les récepteurs se lient aux composés présentaient des différences marquées.
"C'est quelque chose que nous n'avons jamais vu avec les GPCR, " a déclaré Cherezov. " L'idée a toujours été que les récepteurs qui se lient aux mêmes composés auraient des poches très similaires, ainsi les efforts pour développer des médicaments qui agissent sur AT2 ont commencé avec les mêmes structures de base que les médicaments qui agissent sur AT1. Maintenant, nous voyons que nous devrons peut-être commencer avec des molécules de type médicament entièrement différentes qui sont adaptées pour s'adapter au récepteur AT2, ce qui pourrait orienter le processus de découverte de médicaments dans une direction différente. »
Les participants de l'ASU ont aidé à l'analyse des données ainsi qu'à la préparation et à la caractérisation des échantillons. Liu, ancien membre de l'équipe de l'USC, a également aidé à la conception de la construction du récepteur, purification et cristallisation.
Liu souligne que de nombreuses protéines GPCR importantes adaptées aux cibles médicamenteuses ne sont capables de former que de très petits cristaux (moins de 100 microns de longueur) en laboratoire. Historiquement, la capacité de faire croître de gros cristaux de protéines en laboratoire était une condition préalable à l'étude de leur structure 3D à haute résolution, car les cristaux plus petits seraient détruits par le rayonnement synchrotron. Maintenant cependant, l'étude de ces molécules a été révolutionnée grâce à l'utilisation de la technologie XFEL, qui expose les cristaux de la taille du micron à de si courtes rafales de rayonnement qu'ils restent intacts.
ASU est un précurseur dans ce nouveau domaine d'étude, combinant leur expertise dans la production de petits cristaux adéquats pour l'analyse des protéines GPCR avec la capacité d'imager de tels échantillons à une résolution extrêmement élevée en utilisant XFEL.
Le Biodesign Institute a récemment entrepris un projet audacieux pour construire un XFEL compact unique en son genre, capable de réaliser ce type d'analyse structurale de protéines à haute résolution, en réduisant radicalement les coûts et en améliorant l'accessibilité. (Actuellement, il n'existe que 3 grosses machines XFEL, l'installation SLAC à Stanford, DESY à Hambourg, l'Allemagne et le SACLA XFEL, à Harima, Japon.)
« XFEL ouvre la porte à toutes ces cibles protéiques membranaires, " Liu dit, soulignant que le domaine de la cristallographie aux rayons X est maintenant prêt à progresser rapidement.