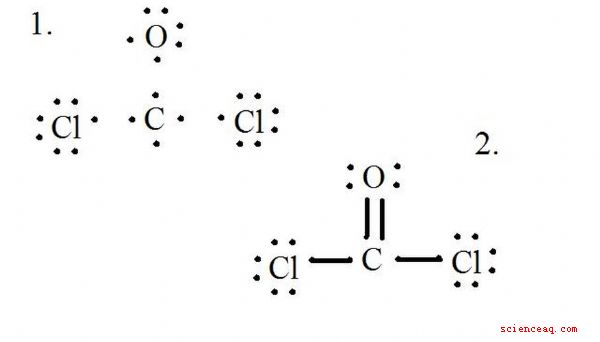
Pour déterminer la charge formelle d'une molécule telle que CoCl2 (gaz phosgène), vous devez connaître le nombre d'électrons de valence pour chaque atome et la structure de Lewis de la molécule.
Valence Electron Number
Recherchez chaque atome dans le tableau périodique des éléments pour déterminer le nombre d'électrons de valence.
Rappelez-vous que deux électrons vont dans la première couche, deux électrons dans la seconde couche, six électrons dans le premier p shell, etc. Pour rappel: 1s (^ 2) 2s (^ 2) 2p (^ 6) 3s (^ 2) 3p (^ 6)
Ajustez pour la charge. Si la molécule est un ion, ajouter ou soustraire globalement un ou plusieurs électrons pour tenir compte de la charge finale.
Pour CoCl2 (Phosgène gazeux): C = 4; O = 6; Cl = 7. La molécule n'est pas ionisée et a une charge neutre. Par conséquent, la quantité totale d'électrons de valence est de 4 + 6 + (7x2) = 24.
Structure de Lewis
Voir le diagramme de la structure de Lewis de CoCl2 (gaz de phosgène). La structure de Lewis représente la structure la plus stable et la plus probable pour une molécule. Les atomes sont dessinés avec des électrons de valence appariés;
Dessinez chaque atome et ses électrons de valence, puis formez des liaisons si nécessaire.
Les atomes de chlorure partagent des liaisons simples avec la molécule de carbone, tandis que l'atome d'oxygène forme une double liaison avec le carbone. Chaque atome dans la structure finale satisfait la règle octet et a huit électrons de valence permettant la stabilité moléculaire.
Charge formelle de chaque atome
Comptez les paires solitaires de chaque atome dans la structure de Lewis. Assignez à chaque atome un électron de chaque liaison à laquelle il participe. Ajouter ces chiffres ensemble. Dans CoCl2: C = 0 paires isolées plus 4 électrons issus de liaisons = 4 électrons. O = 4 électrons provenant de paires isolées plus 2 électrons issus de liaisons = 6 électrons. Cl = 6 électrons provenant de paires isolées plus 1 électron provenant d'une liaison avec C = 7 électrons.
Soustraire la somme du nombre d'électrons de valence dans l'atome non lié. Le résultat est la charge formelle pour cet atome. Dans CoCl2: C = 4 électrons de valence (v.e.) dans l'atome non lié moins 4 électrons assignés dans la structure de Lewis (L.s.) = 0 charge formelle O = 6 v.e. - 6 L. = 0 charge formelle Cl = 7 v.e. - 7 L.s. = 0 charge formelle
Écris ces charges à côté des atomes dans la structure de Lewis. Si la molécule globale a une charge, entourez la structure de Lewis entre parenthèses avec la charge écrite à l'extérieur des parenthèses dans le coin supérieur droit.
Avertissement
Calcul de la charge formelle pour les molécules contenant des métaux de transition être rusé. Le nombre d'électrons de valence pour les métaux de transition sera celui en dehors du noyau de type noble.