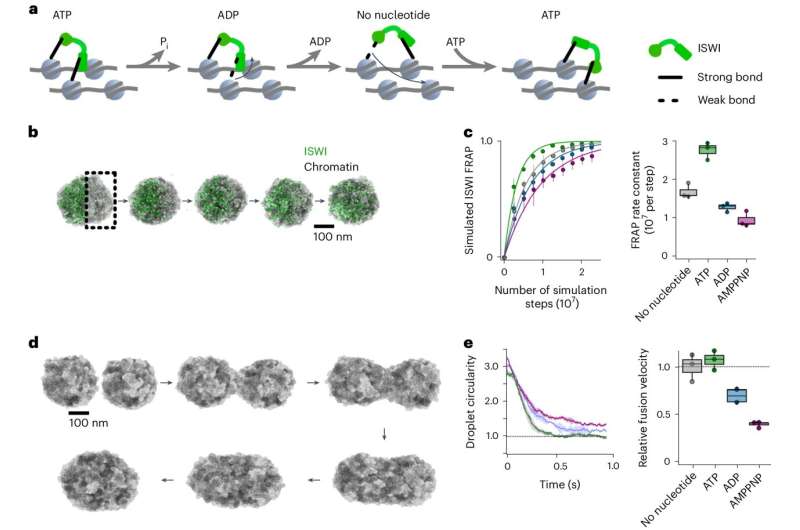
À l’intérieur du noyau cellulaire, la molécule d’ADN se trouve dans un complexe ADN-protéine densément compacté appelé chromatine. Ici, l’ADN est enroulé autour d’un noyau de protéines histones et densément emballé pour former des nucléosomes. La structure des nucléosomes détermine quels gènes sont accessibles et actifs et joue donc un rôle important dans la régulation des gènes. Pour répondre aux signaux métaboliques, aux conditions environnementales modifiées et aux processus de développement, les nucléosomes doivent subir des modifications dynamiques répétées à l'aide d'enzymes.
Une équipe dirigée par le professeur Johannes Stigler du Gene Center Munich du LMU en collaboration avec Felix Müller-Planitz (TU Dresden) a maintenant mené des études pour étudier comment une minuscule enzyme modifiant la chromatine appelée ISWI reste mobile malgré le matériau densément emballé dans le noyau cellulaire et est capable de réorganiser efficacement les nucléosomes.
Les travaux sont publiés dans la revue Nature Structural &Molecular Biology .
Les chercheurs ont pu montrer que l'enzyme consomme de l'ATP, la monnaie énergétique de la cellule, non seulement pour son activité enzymatique, mais aussi pour naviguer dans le noyau cellulaire et pour empêcher la chromatine de devenir trop rigide.
"Le mouvement de l'ISWI à travers l'espace densément rempli de chromatine est alimenté par l'ATP. Au fur et à mesure de sa progression, il continue de s'amarrer alternativement à différents sites de liaison sur les nucléosomes. Nous comparons ce mouvement à celui d'un singe se balançant de branche en branche", explique Stigler.
Selon les chercheurs, le déchiffrement de ces processus pourrait permettre de mieux comprendre comment les défauts contribuent aux maladies et pourrait même ouvrir de nouvelles voies thérapeutiques.
Plus d'informations : Petra Vizjak et al, ISWI catalyse le glissement des nucléosomes dans des réseaux condensés de nucléosomes, Nature Structural &Molecular Biology (2024). DOI :10.1038/s41594-024-01290-x
Informations sur le journal : Biologie structurale et moléculaire de la nature
Fourni par l'Université Ludwig Maximilian de Munich