L'un des nombreux secrets du succès des bactéries réside dans leur capacité à se défendre contre les virus, appelés phages, qui infectent les bactéries et utilisent leur machinerie cellulaire pour se copier.
Les progrès technologiques ont permis d'identifier récemment les protéines impliquées dans ces systèmes, mais les scientifiques continuent d'approfondir leurs recherches sur le rôle de ces protéines.
Dans une nouvelle étude, une équipe de l'Ohio State University a rendu compte de l'assemblage moléculaire de l'un des systèmes anti-phages les plus courants, de la famille des protéines appelées Gabija, dont on estime qu'il est utilisé à au moins 8,5 %. jusqu'à 18 % de toutes les espèces de bactéries sur Terre.
Les chercheurs ont découvert qu'une protéine semble avoir le pouvoir de repousser un phage, mais lorsqu'elle se lie à une protéine partenaire, le complexe résultant est très habile à couper le génome d'un phage envahisseur pour le rendre incapable de se répliquer.
"Nous pensons que les deux protéines doivent former un complexe pour jouer un rôle dans la prévention des phages, mais nous pensons également qu'une seule protéine a une fonction anti-phages", a déclaré Zhangfei Shen, co-auteur principal de l'étude et chercheur postdoctoral. en chimie biologique et pharmacologie au College of Medicine de l'Ohio State. "Le rôle complet de la deuxième protéine doit être étudié plus en détail."
Les résultats contribuent à la compréhension scientifique des stratégies évolutives des micro-organismes et pourraient un jour être traduits en applications biomédicales, affirment les chercheurs.
Shen et co-auteur principal Xiaoyuan Yang, titulaire d'un doctorat. étudiant, travaille dans le laboratoire de l'auteur principal Tianmin Fu, professeur adjoint de chimie biologique et de pharmacologie à l'Ohio State.
L'étude a été publiée le 16 avril dans Nature Structural &Molecular Biology. .

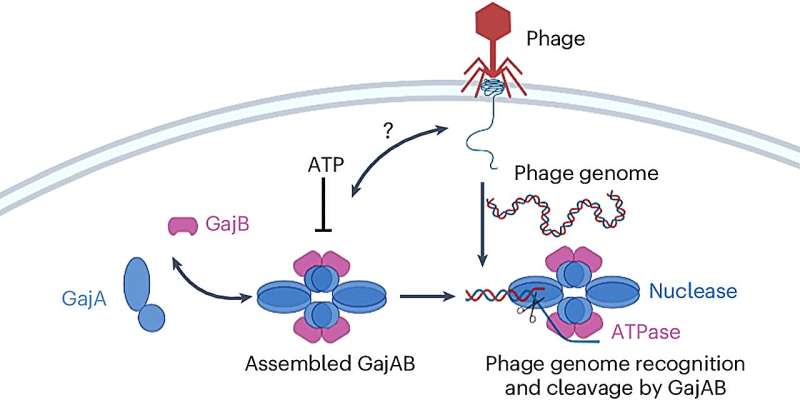
Les deux protéines qui composent ce système de défense sont appelées Gabija A et Gabija B, ou GajA et GajB en abrégé.
Les chercheurs ont utilisé la cryomicroscopie électronique pour déterminer les structures biochimiques de GajA et GajB individuellement et de ce qu'on appelle un complexe supramoléculaire, GajAB, créé lorsque les deux se lient pour former un groupe composé de quatre molécules de chaque protéine.
Dans des expériences utilisant la bactérie Bacillus cereus comme modèle, les chercheurs ont observé l'activité du complexe en présence de phages pour mieux comprendre le fonctionnement du système de défense.
Bien que GajA seul ait montré des signes d'activité susceptibles de désactiver l'ADN d'un phage, le complexe qu'il formait avec GajB était beaucoup plus efficace pour garantir que les phages ne pourraient pas prendre le contrôle de la cellule bactérienne.
"C'est la partie mystérieuse", a déclaré Yang. "GajA seul suffit à cliver le noyau du phage, mais il forme également le complexe avec GajB lorsque nous les incubons ensemble. Notre hypothèse est que GajA reconnaît la séquence génomique du phage, mais GajB améliore cette reconnaissance et aide à couper l'ADN du phage. "
La grande taille et la configuration allongée du complexe ont rendu difficile l'obtention d'une image complète des contributions fonctionnelles de GajB lorsqu'il est lié à GajA, a déclaré Shen, laissant l'équipe formuler certaines hypothèses sur les rôles des protéines qui doivent encore être confirmées.
"Nous savons seulement que GajB contribue à renforcer l'activité de GajA, mais nous ne savons pas encore comment cela fonctionne car nous n'en voyons qu'environ 50 % sur le complexe", a déclaré Shen.
L'une de leurs hypothèses est que GajB pourrait influencer le niveau de concentration d'une source d'énergie, le nucléotide ATP (adénosine triphosphate), dans l'environnement cellulaire, plus précisément en réduisant l'ATP lors de la détection de la présence du phage. Cela aurait le double effet d'étendre l'activité de désactivation de l'ADN du phage de GajA et de voler l'énergie dont un phage aurait besoin pour commencer à se répliquer, a déclaré Yang.
Il reste encore beaucoup à apprendre sur les systèmes de défense anti-phages bactériens, mais cette équipe a déjà montré que le blocage de la réplication virale n’est pas la seule arme de l’arsenal bactérien. Dans une étude précédente, Fu, Shen, Yang et leurs collègues ont décrit une stratégie de défense différente :les bactéries programment leur propre mort plutôt que de laisser les phages prendre le contrôle d'une communauté.
Plus d'informations : Xiao-Yuan Yang et al, Bases moléculaires des assemblages supramoléculaires anti-phages Gabija, Nature Structural &Molecular Biology (2024). DOI :10.1038/s41594-024-01283-w
Informations sur le journal : Biologie structurale et moléculaire de la nature
Fourni par l'Université d'État de l'Ohio