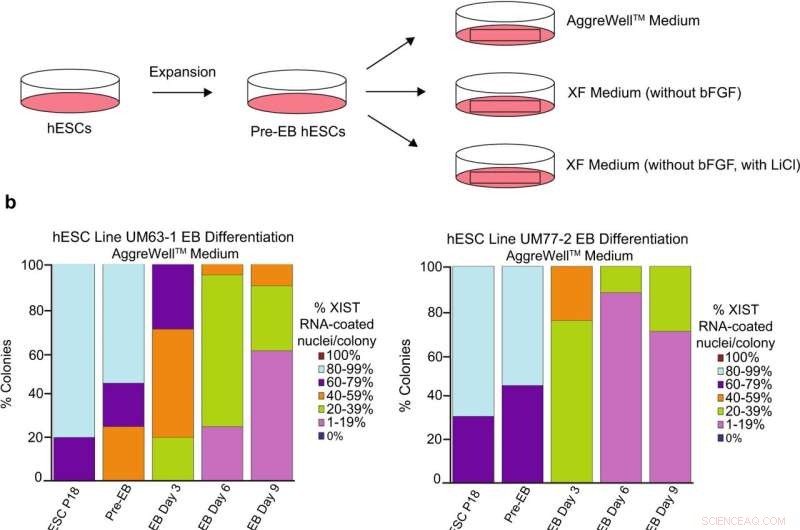
Analyse du revêtement d'ARN XIST lors de la différenciation des CSEh femelles. a Schéma de la différenciation des CSEh en corps embryoïdes (SE) avec trois formulations de milieux différentes :un AggreWell TM disponible dans le commerce moyen; milieu XF dépourvu de bFGF ; et milieu XF dépourvu de bFGF mais contenant 0,98 mM de LiCl. b Pourcentage de noyaux avec revêtement d'ARN XIST dans les EB générés à partir des lignées hESC UM77-2 et UM63-1. EB générés et cultivés dans un milieu XF avec LiCl et AggreWell TM le milieu a perdu une proportion significative de revêtement d'ARN XIST par colonie par rapport aux EB générés et cultivés dans le milieu XF (comparaison de modèle linéaire général ; p < 0,001). Au moins 100 noyaux ont été comptés par colonie pour la quantification de l'ARN FISH hESC. Le nombre total de colonies quantifiées à chaque passage varie entre 10 et 17 et est catalogué dans les données sources. Les données source sont fournies sous la forme d'un fichier de données source. Crédit :Nature Communications (2022). DOI :10.1038/s41467-022-30259-x
Chez la plupart des mammifères, les femelles ont deux chromosomes X et les mâles ont un chromosome X et un chromosome Y dans chacune de leurs cellules. Pour éviter une double dose de gènes liés à l'X chez les femmes, l'un des X est réduit au silence au début du processus de développement. Ce silence est essentiel, mais la manière dont cela se produit est relativement mystérieuse. Deux nouvelles études U-M en révèlent plus sur ce processus de silence et des informations qui pourraient améliorer la recherche sur les cellules souches.
Les cellules souches embryonnaires humaines (CSEh) sont extrêmement prometteuses pour la recherche sur le développement précoce ainsi que pour la médecine régénérative pour des maladies allant du diabète de type 1 à la maladie de Parkinson. Pourtant, les biologistes travaillant avec des CSEh femelles en laboratoire se heurtent souvent à un phénomène dans lequel le chromosome X normalement inactivé perd cette suppression lors de sa croissance dans une boîte de culture.
"Si vous ne pouvez pas maintenir les CSEh exactement telles quelles en culture, vous ne pouvez pas les utiliser pour une application en aval", a déclaré Sundeep Kalantry, Ph.D., professeur agrégé de génétique humaine. Lui, avec Marissa Cloutier, Ph.D. stagiaire et son équipe ont cherché à déterminer pourquoi l'inactivation de l'X s'érode dans certaines conditions expérimentales au fil du temps.
Leur principal suspect était la substance utilisée pour faire croître les cellules en culture, appelée milieu. Les cellules sont cultivées dans des milieux qui leur fournissent des instructions chimiques appelées facteurs de croissance. Ces facteurs de croissance signalent aux cellules souches de continuer à se diviser. Un milieu populaire, appelé mTeSR1, semblait être corrélé à la perte d'un régulateur clé de l'inactivation de X, un brin non codant d'ARN appelé XIST. Un autre milieu, appelé Xenofree, n'a pas entraîné de perte d'inactivation de X.
"Nous avons examiné les différences dans la composition de ces deux milieux et identifié le chlorure de lithium comme étant présent dans mTeSR1 mais pas dans Xenofree", a déclaré Cloutier.
Le chlorure de lithium est parfois inclus dans les milieux pour favoriser la prolifération des cellules souches, cependant, il est connu pour interférer avec de nombreuses voies de signalisation cellulaire en inhibant les protéines GSK-3. (Les inhibiteurs des protéines GSK-3 ont été utilisés pour traiter plusieurs maladies, et le lithium, utilisé pour traiter le trouble bipolaire, a été l'un des premiers inhibiteurs naturels de la GSK-3 découverts.)
Pour confirmer que le chlorure de lithium était le coupable, ils ont ajouté le composé au milieu Xenofree et ont constaté une perte d'inactivation de X. Leur article est publié dans Nature Communications .
"Globalement en termes de notre compréhension de l'inactivation de X, notre étude fournit un nouveau modèle possible pour la régulation de ce processus", déclare Cloutier. Kalantry ajoute que leur étude suggère que les chercheurs doivent être un peu plus prudents quant à l'utilisation d'inhibiteurs de GSK-3 comme le lithium. "Ils peuvent non seulement interférer avec l'inactivation de X, mais aussi avec d'autres modes de régulation transcriptionnelle épigénétique à travers le génome."
Rôle d'un ancien gène lié à l'X dans l'inactivation de l'X
Un article séparé, également publié dans Nature Communications par Kalantry et ses collègues, donne un aperçu de l'évolution de l'inactivation de X chez les mammifères. La prémisse de l'étude était que l'inactivation de X est déclenchée par un ou plusieurs d'un sous-ensemble de gènes liés à l'X qui échappent paradoxalement à l'inactivation de X une fois que l'inactivation de X a commencé. Ces gènes sont exprimés à partir des deux chromosomes X chez les femmes par rapport à un seul X chez les hommes et, par conséquent, sont plus fortement exprimés chez les femmes que chez les hommes. Le laboratoire de Kalantry, en étroite collaboration avec le laboratoire de Shigeki Iwase, également à l'Université du Michigan, a découvert qu'en raison de l'expression plus élevée chez les femmes par rapport aux hommes d'un tel gène lié à l'X, Kdm5c, il induit Xist et donc l'inactivation de X sélectivement chez les femmes .
La suppression de Kdm5c sur les deux chromosomes X dans une cellule femelle a désactivé presque complètement l'inactivation de X. À l'inverse, lorsque les chercheurs ont introduit Kdm5c dans des cellules de souris mâles, ils ont réussi à initier l'inactivation de X, ce qui, dans des circonstances normales, ne se produirait pas.
Kdm5c est un gène lié à l'X ancestral partagé par toutes les espèces de mammifères. Les auteurs ont testé et découvert que Kdm5c de lignées de mammifères marsupiaux et monotrèmes (par exemple, l'ornithorynque pondeur d'œufs) distants de l'évolution, qui se sont séparés des mammifères placentaires il y a plus de 150 millions d'années, pourrait également induire remarquablement Xist et X-inactivation dans les cellules de souris mâles . Cette découverte suggère que Kdm5c a conservé une fonction ancestrale pour induire l'inactivation de Xist et X chez la souris et l'homme.
"Si vous exprimez des gènes liés à l'X à des niveaux supérieurs à la normale dans une cellule féminine, cette cellule souffrira et mourra souvent. Chez les hommes, si vous réduisez l'expression des gènes liés à l'X au-delà des niveaux normaux en inactivant ce seul X, le les cellules souffrent et meurent également », a déclaré Kalantry. "Le bon niveau de gènes du chromosome X est vraiment, vraiment important pour la santé de la cellule."
L'équipe espère ensuite expliquer le processus aléatoire qui détermine quel X dans une cellule féminine est réduit au silence :celui de la mère ou celui du père. La détermination de ce mécanisme de base, dit Kalantry, pourrait à l'avenir être appliquée pour réactiver à volonté les gènes liés à l'X à des fins thérapeutiques potentielles.