Même si vous ne les appréciez pas ou n’en avez même pas entendu parler, d’innombrables machines microscopiques appelées spliceosomes sont à l’œuvre dans tout votre corps. Pendant que vous vous asseyez et lisez, ils reconstituent fidèlement et rapidement les informations brisées dans vos gènes en supprimant des séquences appelées « introns » afin que vos ARN messagers puissent fabriquer les bonnes protéines nécessaires à vos cellules.
Les introns sont peut-être l’un des plus grands mystères de notre génome. Ce sont des séquences d'ADN qui interrompent les informations sensibles codant pour les protéines dans vos gènes et qui doivent être « séparées ». Le génome humain possède des centaines de milliers d'introns, environ 7 ou 8 par gène, et chacun est éliminé par un complexe protéique d'ARN spécialisé appelé « spliceosome » qui coupe tous les introns et assemble les séquences codantes restantes, appelées exons. On ne sait pas comment ce système de gènes brisés et le spliceosome ont évolué dans nos génomes.
Au cours de sa longue carrière, Manny Ares, professeur distingué de biologie moléculaire, cellulaire et du développement à l'UC Santa Cruz, s'est donné pour mission d'en apprendre le plus possible sur l'épissage de l'ARN.
"Je suis tout au sujet du spliceosome", a déclaré Ares. "Je veux juste savoir tout ce que fait le spliceosome, même si je ne sais pas pourquoi il le fait."
Dans un nouvel article publié dans la revue Genes and Development , Ares fait état d'une découverte surprenante sur le spliceosome qui pourrait nous en dire plus sur l'évolution des différentes espèces et sur la façon dont les cellules se sont adaptées à l'étrange problème des introns. Les auteurs montrent qu'une fois que le spliceosome a fini d'épisser l'ARNm, il reste actif et peut engager d'autres réactions avec les introns retirés.
Cette découverte fournit l’indication la plus solide dont nous disposons jusqu’à présent selon laquelle les spliceosomes pourraient être capables de réinsérer un intron dans le génome à un autre endroit. Il s'agit d'une capacité que l'on ne croyait pas auparavant posséder les spliceosomes, mais qui est une caractéristique commune des « introns du groupe II », des cousins éloignés du spliceosome qui existent principalement dans les bactéries.
On pense que les introns du spliceosome et du groupe II partagent un ancêtre commun qui était responsable de la propagation des introns dans tout le génome, mais alors que les introns du groupe II peuvent se séparer de l'ARN puis directement revenir dans l'ADN, les « introns spliceosomes » que l'on trouve dans la plupart des organismes de niveau supérieur ont besoin du spliceosome pour l'épissage et ne devraient pas être réinsérés dans l'ADN. Cependant, les découvertes du laboratoire d'Ares indiquent que le spliceosome pourrait encore réinsérer des introns dans le génome aujourd'hui. Il s'agit d'une possibilité intéressante à considérer, car les introns réintroduits dans l'ADN ajoutent de la complexité au génome, et mieux comprendre d'où proviennent ces introns pourrait nous aider à mieux comprendre comment les organismes continuent d'évoluer.
Les gènes d'un organisme sont constitués d'ADN, dans lequel quatre bases, l'adénine (A), la cytosine (C), la guanine (G) et la thymine (T), sont ordonnées dans des séquences qui codent pour des instructions biologiques, comme la façon de fabriquer des protéines spécifiques dans l'organisme. besoins. Avant que ces instructions puissent être lues, l'ADN est copié en ARN par un processus appelé transcription, puis les introns de cet ARN doivent être retirés avant qu'un ribosome puisse le traduire en protéines réelles.
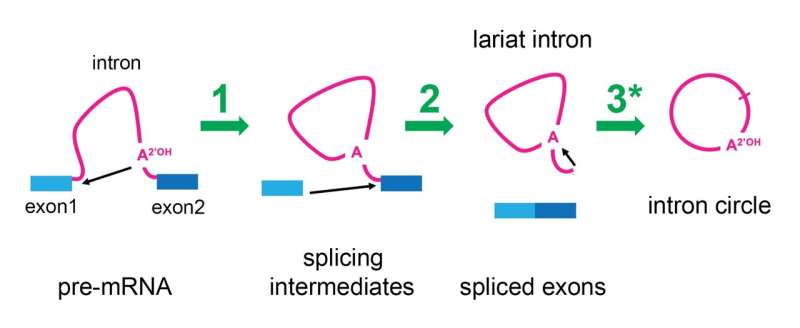
Le spliceosome élimine les introns à l'aide d'un processus en deux étapes qui aboutit à ce que l'ARN de l'intron ait une de ses extrémités jointe à son milieu, formant un cercle avec une queue qui ressemble à un « lasso » ou un lasso de cow-boy. Cette apparence leur a valu d'être appelés «introns lariat». Récemment, des chercheurs de l'Université Brown qui étudiaient l'emplacement des sites de jonction dans ces lariats ont fait une observation étrange :certains introns étaient en fait circulaires au lieu d'avoir la forme d'un lariat.
Cette observation attira immédiatement l'attention d'Arès. Quelque chose semblait interagir avec les introns du lariat après qu'ils aient été retirés de la séquence d'ARN pour changer leur forme, et le spliceosome était son principal suspect.
"J'ai pensé que c'était intéressant à cause de cette vieille, vieille idée sur l'origine des introns", a déclaré Ares. "Il existe de nombreuses preuves que les parties ARN du spliceosome, les snRNA, sont étroitement liées aux introns du groupe II."
Étant donné que le mécanisme chimique d'épissage est très similaire entre les spliceosomes et leurs cousins éloignés, les introns du groupe II, de nombreux chercheurs ont émis l'hypothèse que lorsque le processus d'auto-épissage devenait trop inefficace pour que les introns du groupe II puissent se terminer par eux-mêmes de manière fiable, des parties de ces introns ont évolué pour devenir le spliceosome. Alors que les introns du groupe II étaient capables de se réinsérer directement dans l'ADN, on ne pensait pas que les introns spliceosomal qui nécessitaient l'aide de spliceosomes pouvaient être réinsérés dans l'ADN.
"L'une des questions qui manquait en quelque sorte dans cette histoire dans mon esprit était la suivante :est-il possible que le spliceosome moderne soit encore capable de prendre un intron lariat et de l'insérer quelque part dans le génome ?" dit Arès. "Est-il encore capable de faire ce que le complexe ancêtre a fait ?"
Pour commencer à répondre à cette question, Ares a décidé de rechercher si c'était effectivement le spliceosome qui apportait des modifications aux introns du lariat pour supprimer leurs queues. Son laboratoire a ralenti le processus d'épissage dans les cellules de levure et a découvert qu'après que le spliceosome ait libéré l'ARNm à partir duquel il avait fini d'épisser les introns, il s'accrochait aux lariats d'introns et les remodelait en de véritables cercles. Le laboratoire Ares a pu réanalyser les données publiées sur le séquençage de l'ARN de cellules humaines et a découvert que les spliceosomes humains possédaient également cette capacité.
"Nous sommes enthousiasmés par cela car même si nous ne savons pas ce que cet ARN circulaire pourrait faire, le fait que le spliceosome soit toujours actif suggère qu'il pourrait être capable de catalyser l'insertion de l'intron lariat dans le génome", a déclaré Ares.
Si le spliceosome est capable de réinsérer l'intron dans l'ADN, cela ajouterait également un poids significatif à la théorie selon laquelle les spliceosomes et les introns du groupe II partageaient un ancêtre commun il y a longtemps.
Maintenant qu'Ares et son laboratoire ont montré que le spliceosome a la capacité catalytique de replacer hypothétiquement des introns dans l'ADN comme l'ont fait leurs ancêtres, la prochaine étape consiste pour les chercheurs à créer une situation artificielle dans laquelle ils « nourrissent » un brin d'ADN à un spliceosome qui est toujours attaché à un intron lariat et voir s'ils peuvent réellement lui faire insérer l'intron quelque part, ce qui présenterait une "preuve de concept" pour cette théorie.
Si le spliceosome est capable de réinsérer des introns dans le génome, il s’agira probablement d’un événement très rare chez l’homme, car les spliceosomes humains sont extrêmement demandés et n’ont donc pas beaucoup de temps à consacrer aux introns retirés. Cependant, dans d'autres organismes où le spliceosome n'est pas aussi occupé, la réinsertion des introns peut être plus fréquente. Ares travaille en étroite collaboration avec le professeur d'ingénierie biomoléculaire de l'UCSC, Russ Corbett-Detig, qui a récemment mené une recherche systématique et exhaustive de nouveaux introns dans les génomes disponibles de toutes les espèces contenant des introns, publiée dans la revue Proceedings of the National Academy. des Sciences (PNAS ) l'année dernière.
L'article publié dans PNAS a montré que des événements d'"éclatement" d'introns très anciens dans l'histoire de l'évolution ont probablement introduit des milliers d'introns dans un génome d'un seul coup. Ares et Corbett-Detig travaillent actuellement à recréer artificiellement un événement de sursaut, ce qui leur donnerait un aperçu de la réaction des génomes lorsque cela se produit.
Ares a déclaré que son partenariat interdisciplinaire avec Corbett-Detig leur a ouvert la porte pour vraiment creuser certains des plus grands mystères des introns qu'il leur serait probablement impossible de comprendre pleinement sans leur expertise combinée.
"C'est la meilleure façon de faire les choses", a déclaré Ares. "Lorsque vous trouvez quelqu'un qui a le même genre de questions en tête mais un ensemble différent de méthodes, de perspectives, de préjugés et d'idées étranges, cela devient encore plus excitant. Cela vous donne l'impression que vous pouvez sortir et résoudre un problème comme celui-ci, ce qui est très complexe."
Plus d'informations : Manuel Ares et al, Les spliceosomes de lariat d'intron convertissent les lariats en cercles vrais :implications pour la transposition d'intron, Gènes et développement (2024). DOI : 10.1101/gad.351764.124
Informations sur le journal : Actes de l'Académie nationale des sciences , Gènes et développement
Fourni par l'Université de Californie - Santa Cruz