Les systèmes CRISPR-Cas ont révolutionné la biotechnologie en offrant des moyens de modifier les gènes comme une paire de ciseaux programmables. Dans la nature, les bactéries utilisent ces systèmes pour combattre les virus mortels. Une récente collaboration internationale dirigée par l'Université de Copenhague a mis en lumière les systèmes CRISPR-Cas les plus énigmatiques ; le système de type IV. Bien que ces systèmes atypiques ne coupent pas les gènes, leurs fonctions uniques sont prometteuses dans notre lutte contre la résistance aux antibiotiques.
Les systèmes CRISPR-Cas sont des systèmes immunitaires adaptatifs bactériens qui ciblent et coupent les acides nucléiques (ADN/ARN) des parasites génétiques envahisseurs comme les bactériophages (phages); virus qui infectent – et finissent par tuer – les cellules bactériennes. Ils se composent de deux éléments principaux ; le réseau CRISPR, qui stocke la mémoire immunitaire des infections virales passées, et les gènes cas (codant pour les protéines Cas), responsables de la coordination des différentes étapes de la réponse immunitaire.
Il existe actuellement six types connus de systèmes CRISPR-Cas, classés en fonction de leur composition protéique. Tous les types, à l'exception du type IV, incluent des nucléases pour le clivage ADN/ARN.
Les systèmes CRISPR-Cas ont gagné en popularité en tant qu'outils d'édition génétique, permettant des coupes programmables précises à des emplacements génomiques spécifiques, ce qui a finalement conduit à l'attribution du prix Nobel de chimie 2020 pour le développement de cette technologie.
"Les systèmes de type IV sont les étranges cousins parmi les systèmes CRISPR-Cas, car ils ne disposent pas du module d'acquisition de la mémoire immunitaire et du composant de coupe d'ADN qui ont rendu les systèmes CRISPR-Cas si célèbres. Ces caractéristiques, et leur association stricte avec des molécules d'ADN circulaires mobiles, "Cell Host &Microbe .
La particularité de CRISPR-Cas étant leur capacité à couper l'ADN à des sites spécifiques, les systèmes de type IV fonctionnent d'une manière totalement différente. Ils ne possèdent pas les « ciseaux » typiques des nucléases, mais abritent à la place une hélicase DinG, une mystérieuse protéine qui déroule l'ADN.
"Le tournant de cette enquête s'est produit lorsque nous avons réalisé que les systèmes de type IV ne coupent pas l'ADN. Au lieu de cela, nous avons constaté qu'ils inhibent l'expression des gènes à leurs emplacements cibles. Il s'agit d'une fonctionnalité unique qui pourrait avoir d'importantes applications biotechnologiques", explique Rafael Pinilla. -Redondo, professeur adjoint au Département de biologie et coordinateur principal de la recherche.
Les chercheurs ont réalisé une autre avancée majeure lorsqu'ils ont découvert comment ces systèmes pouvaient fonctionner sans les composants nécessaires pour créer une mémoire immunitaire.
"Les systèmes de type IV peuvent contourner l'absence de module d'acquisition de mémoire en détournant les modules compatibles d'autres systèmes CRISPR-Cas présents dans la bactérie hôte. C'est fascinant car ces autres systèmes ne sont liés que de manière lointaine", explique Sarah Camara-Wilpert, co- premier auteur de cette étude.
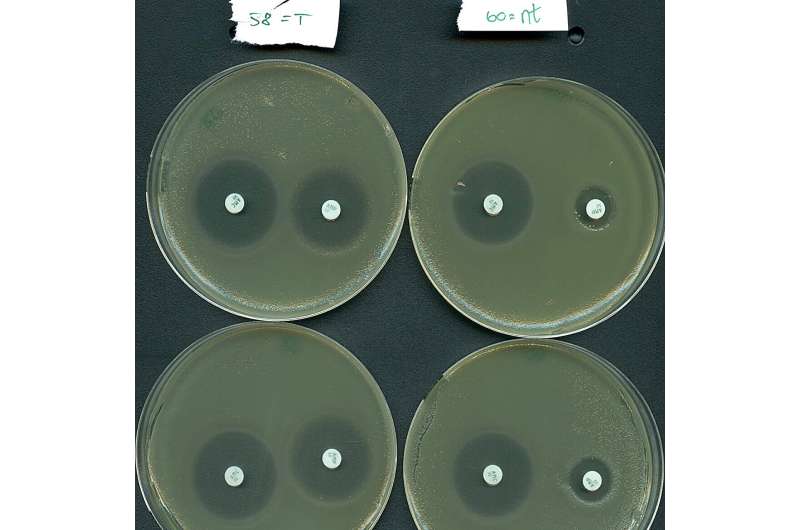
Mais pourquoi tout ce battage médiatique ? Eh bien, il s’avère que les systèmes de type IV ont une tendance marquée à cibler naturellement les plasmides plutôt que les virus bactériens. Il est important de noter que les plasmides ciblés hébergent fréquemment plusieurs gènes de résistance aux antibiotiques, comme ceux trouvés dans les superbactéries hospitalières. On estime que la résistance aux antimicrobiens est directement responsable de plus d'un million de décès par an dus à l'échec du traitement.
Inspirées par leur fonction naturelle de ciblage des plasmides, les équipes de recherche ont reprogrammé efficacement un système de type IV pour faire taire sélectivement les gènes de résistance portés par une bactérie à haut risque provenant de patients hospitalisés.
"Nos résultats indiquent que les systèmes de type IV présentent un potentiel en tant que nouveau moyen de lutter contre la résistance aux antibiotiques, car nous avons pu resensibiliser un agent pathogène important au traitement antibiotique", déclare le professeur Søren Sørensen, co-dernier auteur de l'étude.
Cette étude était un effort interdisciplinaire majeur impliquant sept groupes de recherche internationaux de divers pays. Alors que le projet a commencé comme une collaboration entre deux groupes seulement, il a progressivement pris de l'ampleur, attirant des partenaires aux expertises diverses.
« Nous avons connu un merveilleux effet boule de neige, où chaque nouveau partenaire a amplifié l'impact du travail en partageant ses compétences uniques et en fournissant des informations cruciales pour résoudre les mystères entourant les systèmes de type IV. Cela a été un tour de force collaboratif, exactement comme la science devrait l'être", note Pinilla-Redondo.
Plus d'informations : Fabienne Benz et al, les systèmes CRISPR-Cas de type IV-A3 génèrent des conflits inter-plasmidiques en acquérant des espaceurs en trans, Cell Host &Microbe (2024). DOI :10.1016/j.chom.2024.04.016
Informations sur le journal : Hôte cellulaire et microbe
Fourni par l'Université de Copenhague