Des chercheurs dirigés par le professeur Zhang Zairong de l'Institut de chimie organique de Shanghai de l'Académie chinoise des sciences ont identifié une voie de topogenèse post-traductionnelle pour le repliement et l'assemblage de protéines membranaires multi-spanning (MSP).
Sur les quelque 5 000 protéines membranaires synthétisées au niveau de la membrane du réticulum endoplasmique (RE) des cellules humaines, plus de la moitié sont des MSP qui jouent un rôle essentiel dans la physiologie cellulaire et organique, fonctionnant comme canaux ioniques, transporteurs, récepteurs et enzymes intramembranaires.
Une proportion importante de ces fonctions repose sur des acides aminés polaires et chargés, conduisant à la formation de TMD peu hydrophobes (pTMD). Cependant, les pTMD ont du mal à être reconnus et intégrés dans la bicouche phospholipidique par le translocon Sec61, qui préfère les TMD hydrophobes.
Dans le protéome humain, environ 30 % des protéines membranaires et plus de 50 % des MSP contiennent au moins un pTMD. La manière dont ces pTMD sont efficacement identifiées et regroupées avec précision dans des structures MSP matures a été une question scientifique majeure.
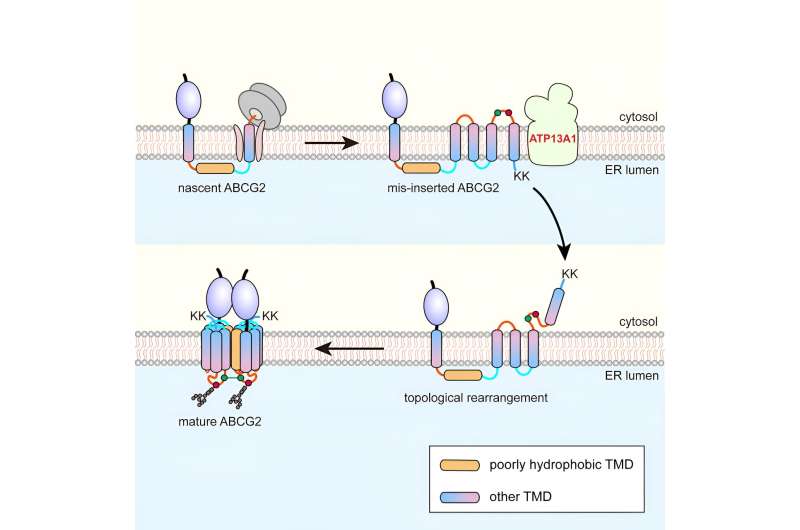
En utilisant comme modèle le transporteur G2 (ABCG2) de cassette de liaison à l'adénosine triphosphate de protéine à six étendues, les chercheurs ont découvert que pendant la translocation co-traductionnelle, le pTMD2 de ABCG2 traverse le pore central du translocon dans la lumière du RE, plutôt que d'être intégré dans la bicouche phospholipidique à travers la porte latérale du translocon.
Cela entraîne l'insertion de TMD en aval dans la membrane ER avec des orientations inversées, formant ainsi un intermédiaire unique. Suite à la traduction des résidus lysine jumeaux chargés positivement C-terminaux, un processus de réarrangement topologique quasi global se produit.
La purification par affinité a montré que ATP13A1 peut détecter le signal de charge positive C-terminal de ABCG2. Le remplacement des résidus lysine par des acides aminés chargés négativement ou neutres atténue considérablement les interactions entre les mutants ATP13A1 et ABCG2.
De plus, l’inactivation de l’ATP13A1 a entraîné une accumulation apparente de conformations ABCG2 mal repliées, principalement celles présentant un TMD6 mal orienté dans la membrane du RE. Ainsi, ATP13A1 joue un rôle crucial dans la topogenèse des MSP, où son activité ATPase favorise la dislocation du TMD6 mal orienté de la bicouche lipidique vers le cytosol.
Par la suite, le TMD6 cytosolique est réintégré dans la membrane du ER, entraînant ainsi le réarrangement topologique post-traductionnel des autres TMD en amont.
Après un réarrangement réussi des TMD 4 à 6, l'intermédiaire peut s'oligomériser en une structure quaternaire. Ce processus est susceptible de faciliter l'intégration de pTMD2 dans la structure finale à partir de la lumière aqueuse du ER et dans la structure mature, qui est étroitement enveloppée par les TMD environnants.
En résumé, l'étude, maintenant publiée dans Molecular Cell , explique comment un pTMD « difficile » est ignoré co-traductionnellement pour l'insertion et enterré post-traductionnellement dans la structure finale correcte au stade tardif du repliement, évitant ainsi une exposition excessive aux lipides.
Notamment, en raison de l'exposition de pTMD2 à la lumière du RE au cours de la topogenèse ABCG2, la modification de la glycosylation N441 provoquée par la mutation génétique ABCG2-S441N peut bloquer de manière significative l'assemblage de pTMD à un stade avancé de la topogenèse. Comme ABCG2 est un transporteur d'acide urique, cette étude explique comment cette mutation est étroitement associée à des maladies humaines telles que la goutte et l'hyperuricémie.
Plus d'informations : Jia Ji et al, Une voie de topogenèse assistée par ATP13A1 pour le repliement de protéines membranaires multi-spanning, Molecular Cell (2024). DOI :10.1016/j.molcel.2024.04.010
Informations sur le journal : Cellule moléculaire
Fourni par l'Académie chinoise des sciences