Deux kinésines porteuses lorsqu'elles transportent une cargaison le long d'un microtubule (cyan). Des chercheurs de l'Université Rice et de l'Université de Houston ont déterminé que les protéines motrices répondent mieux aux forces fortes et presque pas aux forces faibles, même ceux appliqués par des moteurs attachés à la même cargaison. Dans cet exemple, la kinésine principale (LK) porte la majeure partie de la charge, avec des têtes motrices (bleues) activées par un lien de cou (jaune) qui se connecte à la tige (rouge) et détecte la présence de la cargaison. Crédit : Centre de physique biologique théorique/Université du riz
Si vous êtes la protéine motrice à l'avant, soyez prêt à faire le gros du travail.
C'est l'une des conclusions d'une étude menée par l'Université Rice sur les mécanismes qui commandent les kinésines, protéines motrices qui transportent la cargaison à l'intérieur des cellules. L'étude montre qu'il faut beaucoup de contre-force pour ralentir une kinésine déterminée. La protéine ne reçoit pas non plus beaucoup d'aide des collègues qui ferment la marche.
L'étude théorique détaillée dans le Actes de l'Académie nationale des sciences et dirigé par le chercheur postdoctoral Rice Qian Wang était un effort de collaboration des laboratoires de trois professeurs à Rice et un à l'Université de Houston, travaillant tous sous l'égide du Rice's Center for Theoretical Biological Physics (CTBP).
Ils espèrent enrichir les connaissances sur les chevaux de bataille peu compris à l'intérieur des cellules qui sont essentiels à la division cellulaire ainsi qu'au transport de marchandises. Des kinésines défectueuses ou déficientes sont impliquées dans la maladie de Charcot-Marie-Tooth et certaines maladies rénales.
Grâce à des simulations informatiques, les chercheurs fournissent les premiers détails au niveau moléculaire sur la façon dont les kinésines réagissent aux forces externes tout en confirmant des expériences antérieures du co-auteur Michael Diehl qui ont montré que les équipes de kinésines ne fonctionnent mieux que lorsqu'elles sont à proximité et peuvent tirer dans la même direction.
"Nous comprenons plus ou moins les moteurs simples, " a déclaré le biophysicien et co-auteur de Rice Anatoly Kolomeisky, dont les recherches antérieures ont montré que les protéines motrices sont sensibles à la présence d'autres. "Dans la nature, ils travaillent en équipe, mais parce que les moteurs répondent relativement faiblement à une gamme de forces importante, nous soutenons que c'est la principale raison pour laquelle les kinésines ne coopèrent pas toujours les unes avec les autres."
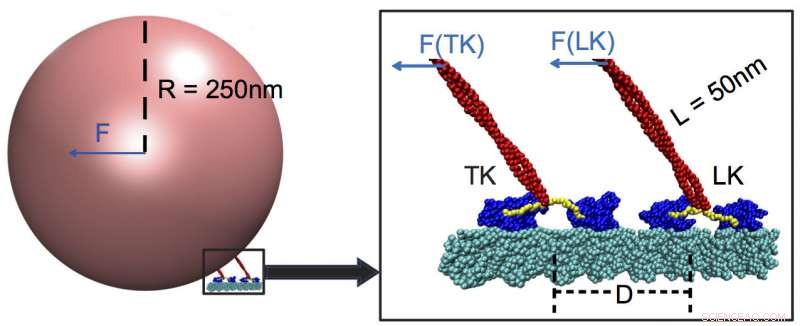
Les kinésines transforment l'énergie de l'ATP chimique, ou adénosine triphosphate, en action mécanique. Ils s'attachent à de grandes cargaisons comme les mitochondries ou les chromosomes et les tirent le long des filaments du cytosquelette jusqu'aux confins d'une cellule. Chaque kinésine contient deux sous-unités « têtes », et chaque sous-unité contient deux sites de liaison, l'un pour saisir et marcher le long des microtubules et l'autre pour lier l'ATP.
Les modèles ont montré des kinésines, une famille de molécules motrices découverte en 1985, sont « faiblement sensibles » aux forces extérieures petites ou moyennes et tirent leur cargaison à travers une opposition presque très forte. Parmi les forces faibles sont celles appliquées par les kinésines traînantes attachées à la même cargaison.
Il s'avère que ces coéquipiers s'enregistrent à peine auprès du boss kinesin s'ils sont à plus de 48 nanomètres. Quand c'est le cas, la kinésine de plomb porte plus de 90 pour cent de la charge.
Les simulations de Rice ont révélé que le leader accorde plus d'attention à la traction de la cargaison elle-même, qui déclenche un "switch" dans le neck linker, partie de la tige qui tire la cargaison comme une ficelle sur un ballon. Le lieur couple la cargaison aux sites de liaison ATP des moteurs principaux, qui à son tour contrôle la vitesse. Une kinésine trop éloignée ne ressent pas la force et ne peut donc pas apporter son muscle.
"Quand le moteur tourne, le lien du cou devient tendu, " a déclaré le biophysicien de Rice José Onuchic, co-auteur et co-directeur du CTBP. "Si cet éditeur de liens n'est pas tendu, le moteur perd de la vitesse car il ne peut pas prendre de décision tout seul. Cette compétition entre la contrainte et la liaison au microtubule est nécessaire pour garantir la processivité de ce moteur."
La simulation de base permettra aux chercheurs de tester plus de kinésines qui déplacent la cargaison du noyau vers les limites extérieures de la cellule et, finalement, dynéines, des protéines plus grosses et plus complexes qui déplacent la cargaison vers le centre.
"Vous devez faire cette première étape très bien et avec beaucoup de détails pour prendre confiance avant de vous attaquer à une bête comme Dynein, " Diehl a déclaré. "Ces gars ont travaillé très dur pendant des années à travers de multiples études et se sont réunis, collectivement, un moyen d'énumérer et d'analyser les transitions entre les étapes clés de ce processus mécanique.
"Maintenant, être capable d'adopter cette approche pour un moteur comme le dynein a l'opportunité d'expliquer beaucoup de choses importantes, mystères fondamentaux sur le fonctionnement d'une protéine complexe, " il a dit.
"C'est le genre d'étude qu'un seul chercheur principal aurait du mal à faire, " a déclaré Onuchic. "Pour des problèmes aussi compliqués, c'est bien d'avoir cette combinaison de talents."