Des scientifiques du laboratoire national de Brookhaven du ministère américain de l'Énergie (DOE) ont découvert qu'une protéine responsable de la synthèse d'un matériau végétal clé a évolué beaucoup plus tôt que prévu. La recherche publiée dans The Plant Cell , explore l'origine et l'évolution de la machinerie biochimique qui produit la lignine, un composant structurel des parois cellulaires végétales ayant des impacts significatifs sur l'industrie de l'énergie propre.
Lorsque les premières plantes terrestres ont émergé des milieux aquatiques, elles ont dû s'adapter pour survivre.
Chang-Jun Liu, scientifique principal au département de biologie de Brookhaven, a déclaré :« L'émergence de la lignine, qui fournit un support structurel aux plantes, a été un événement évolutif clé qui a permis la survie des plantes dans le nouvel environnement terrestre. »
Comprendre comment les plantes ont développé des mécanismes de protection qui leur permettent de survivre dans de nouveaux environnements est essentiel alors qu’elles sont aujourd’hui confrontées aux défis imposés par le changement climatique. Mais la lignine présente également un grand intérêt pour les chercheurs à la recherche d'options énergétiques propres.
Cette matière végétale résistante peut être transformée et transformée en bioproduits précieux. Et la lignine est la seule source renouvelable de composés aromatiques, qui sont chimiquement similaires aux molécules présentes dans le carburéacteur conventionnel et peuvent être utilisées comme carburant « d'appoint » par les compagnies aériennes.
"Les plantes modernes contiennent trois types de lignine, mais la plupart des premières plantes contenant de la lignine n'en avaient que deux types. La lignine la plus récente est appelée syringyl-lignine, ou S-lignine", a expliqué Liu. La S-lignine a évolué relativement récemment avec les plantes à fleurs et est structurellement moins complexe que les autres composants de la lignine. Ses applications industrielles potentielles, en particulier, ont attiré l'attention des scientifiques car la S-lignine est relativement facile à décomposer en composés aromatiques simples.
La nouvelle étude s'appuie sur des années de recherche axées sur la lignine et les molécules responsables de sa synthèse. En 2019, Liu et ses collègues ont découvert qu'une protéine spécifique du cytochrome b5, CB5D, est indispensable à la production de lignine S, mais pas des autres types de lignine plus anciens.
"Le caractère unique du rôle du CB5D dans la synthèse de la S-lignine nous a intrigués", a noté Liu. "Nous avons donc eu envie d'explorer davantage son origine et son évolution."
Dans une étude précédente, l'équipe de Liu a découvert que CB5D avait un partenariat spécial avec une enzyme appelée ferulate 5-hydroxylase (F5H). Ensemble, ces molécules ont synthétisé la précieuse S-lignine.
Les scientifiques savaient que l’évolution du F5H dans les plantes à fleurs avait conduit à la production de S-lignine. Ils s'attendaient donc à découvrir que CB5D avait co-évolué avec F5H.

Pour explorer leur hypothèse, les scientifiques ont effectué une analyse génétique pour trouver d’autres espèces végétales dont l’ADN contenait des gènes similaires au gène CB5D moderne, qui sert d’instructions pour l’assemblage de la protéine CB5D. Ils ont identifié 21 espèces, allant de l’évolution ancienne à l’évolution récente. Les scientifiques ont ensuite synthétisé ces gènes et les ont exprimés individuellement dans une espèce végétale moderne génétiquement modifiée pour ne pas contenir le gène CB5D.
"Sans le gène CB5D, la plante ne synthétise qu'une petite quantité de S-lignine", a déclaré Xianhai Zhao, chercheur postdoctoral à Brookhaven et auteur principal du nouvel article. "Mais si cette fonction était restaurée avec l'expression d'un des gènes associés, alors nous saurions que ce gène fonctionne de manière similaire au gène CB5D moderne."
Les scientifiques ont découvert qu'un gène provenant d'une espèce d'algue verte qui a évolué pour devenir une première plante terrestre il y a plus de 500 millions d'années a restauré la synthèse de la S-lignine dans la plante moderne. Cela indique que le gène présente une fonctionnalité de type CB5D. Les scientifiques ont également découvert que cette fonction était conservée dans plusieurs premières plantes terrestres, comme les hépatiques et les mousses.
"Cela signifie que le CB5D a évolué des millions d'années plus tôt que prévu", a expliqué Liu. "Il était assez surprenant de découvrir qu'un accepteur d'électrons moderne tel que F5H s'était associé à une protéine ancienne pour développer une nouvelle machinerie biochimique synthétisant la structure avancée de la lignine."
Le gène CB5D et son homologue plus ancien contenaient des séquences et des fonctions d’ADN similaires. Mais les scientifiques voulaient s'assurer que la protéine CB5D d'une espèce ancienne, comme l'hépatique, était exprimée dans les mêmes structures subcellulaires que la CB5D moderne.
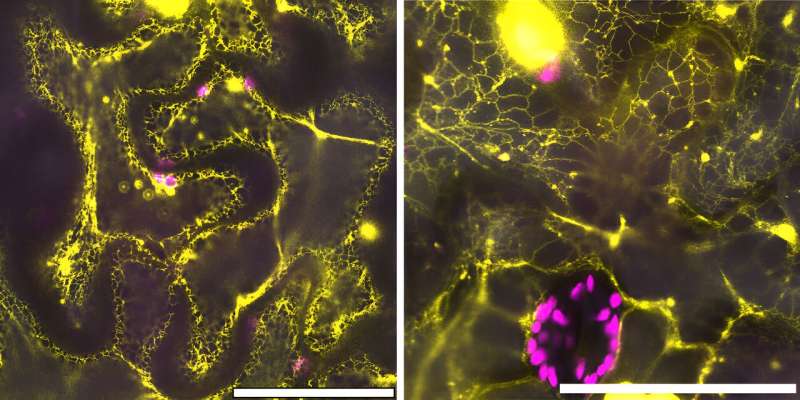
Ils ont donc utilisé la microscopie confocale au Center for Functional Nanomaterials, un établissement utilisateur du DOE Office of Science au Brookhaven Lab, pour confirmer que c'était bien le cas.
Après avoir trouvé d'anciens gènes codant pour des protéines similaires à la protéine CB5D moderne en termes de synthèse de S-lignine dans les plantes modernes et de localisation cellulaire, l'équipe a voulu en savoir plus sur la fonction ancienne de cette protéine et comment elle a changé ou s'est développée au fil du temps.
Leur analyse a montré que la protéine de type CB5D a émergé dans les algues aquatiques juste avant leur transition vers un environnement terrestre. Et comme elle a été conservée dans les premières plantes terrestres, cette protéine remplit probablement une ou plusieurs fonctions essentielles.
"Les plantes anciennes comme l'hépatique ne contenaient pas de S-lignine", a déclaré Zhao. "Si la protéine de type CB5D n'était pas responsable de la synthèse de la S-lignine, qu'a-t-elle fait ?"
Liu a fait remarquer :"C'est la beauté de la recherche. Répondre à une question vous mène à des questions encore plus intéressantes qui attendent d'être explorées."
Plus d'informations : Xianhai Zhao et al, La diversité du cytochrome b5 dans les lignées vertes a précédé l'évolution de la biosynthèse de la lignine syringyl, La cellule végétale (2024). DOI : 10.1093/plcell/koae120
Informations sur le journal : Cellule végétale
Fourni par le Laboratoire national de Brookhaven