La transcription de l'ARN est le processus génomique dans lequel une cellule produit une copie de la séquence d'ADN d'un gène. Dans une étude publiée dans Nucleic Acids Research , professeur Jun Zhang, Ph.D. du département de chimie de l'université d'Alabama à Birmingham, et son équipe révèlent comment la protéine SRSF1 possède la nouvelle fonction de liaison et de déploiement des quadruplexes complexes d'ARN guanine.
Présent dans les séquences d’ADN et d’ARN, un G-quadruplex (GQ) est une structure de quatre bases guanine attachées dans un réseau planaire. Ces réseaux, appelés G-tétrade, sont connectés via des appariements de bases de Hoogsteen. Il est courant de constater que trois couches ou plus de G-tétrades constituent une structure GQ.
Dans une cellule fonctionnant normalement, la plupart des GQ sont finalement déroulées, de sorte que les informations codées par l'ARN puissent être utilisées pour l'expression des protéines. Les GQ sont couramment utilisés pour réguler le niveau d’expression des protéines. Cependant, en raison de l'extrême stabilité de leurs structures, les GQ sont relativement difficiles à dérouler une fois formés en cellules.
Par exemple, si le GQ n’est pas déroulé, le ribosome ne peut pas le traverser et la protéine nécessaire ne peut pas être produite. Cette fonction régulatrice est importante car, si la protéine fonctionne pour supprimer les cellules cancéreuses, alors une incapacité à dérouler une séquence GQ peut entraîner la réplication de cellules cancéreuses et malveillantes.
"C'est important car comprendre comment nous pouvons facilement ouvrir les structures GQ pourrait ouvrir une autre voie vers l'avenir des options de traitement pour certaines maladies", a déclaré Zhang. "Il n'existait auparavant aucun autre outil externe que nous puissions facilement utiliser pour ouvrir ces structures dans la cellule."
Zhang et son équipe ont étudié la famille des protéines riches en Ser/Arg, ou SR.
Il existe 12 membres de la famille des protéines SR. Cette famille de protéines liant l’ARN est surtout connue pour l’épissage de l’ARN. SRSF1 supervise l'épissage de plus de 1 500 transcriptions différentes d'ARN messager.
"Un dysfonctionnement de l'épissage peut entraîner le développement de différentes maladies telles que le cancer", a déclaré Zhang. "Environ 60 % des maladies peuvent en réalité être attribuées à un dysfonctionnement de l'épissage."
Chaque membre de la famille des protéines SR se compose d'un ou deux motifs de reconnaissance d'ARN N-terminaux, ou RRM, et d'une région protéique C-terminale phosphorylable riche en dipeptides Arg/Ser répétitifs, ou RS.
Le laboratoire de Zhang est le premier à réussir à solubiliser SRSF1 complet dans son état natif. L’équipe de Zhang a utilisé cela pour explorer le paysage de liaison à l’ARN de SRSF1. Ce faisant, l'équipe de Zhang a découvert que SRSF1 RS préfère la purine à la pyrimidine.
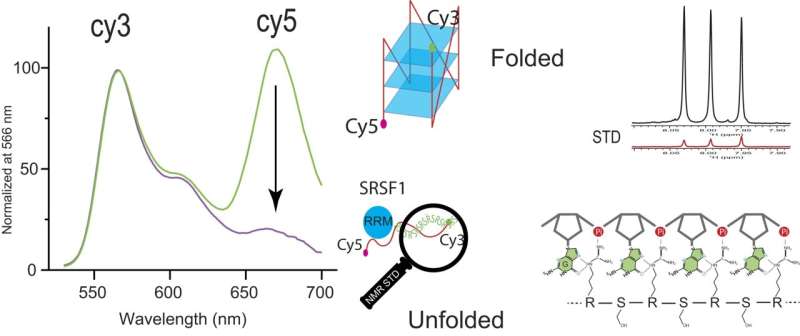
En utilisant le transfert d'énergie de résonance de fluorescence, ou FRET, entre les produits chimiques fluorescents Cy3 et Cy5, Zhang et son équipe ont pu observer la diminution significative du signal Cy5 lors de l'ajout de SRSF1. Cette diminution signifie une liaison coopérative de SRSF1 à ARPC2 GQ et un déploiement de ARPC2 GQ.
"Nos découvertes ne sont qu'un début pour comprendre les rôles plus larges que jouent les protéines SR dans l'épissage et la traduction de l'ARN", a déclaré Zhang. "Comprendre ces propriétés est important car cela nous aide à mieux comprendre comment l'expression des protéines est régulée à l'intérieur de la cellule."
Plus d'informations : Naiduwadura Ivon Upekala De Silva et al, Découverte d'une nouvelle fonction de SRSF1 dans la liaison et le déploiement des quadruplexes G d'ARN, Recherche sur les acides nucléiques (2024). DOI : 10.1093/nar/gkae213
Informations sur le journal : Recherche sur les acides nucléiques
Fourni par l'Université d'Alabama à Birmingham