Résumé graphique. Crédit :Cellulaire (2022). DOI :10.1016/j.cell.2022.04.023
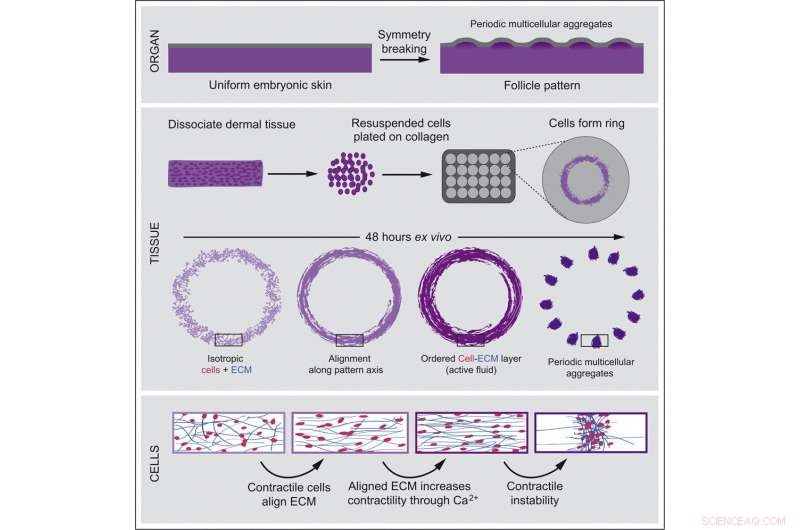
Le développement précoce est comme une danse soigneusement chorégraphiée, avec des bandes uniformes de cellules s'organisant en motifs élaborés - une première étape vers la formation d'organes fonctionnels. Une couche plate de cellules cutanées, par exemple, doit se transformer en une couche parsemée de rangées nettes de cellules ciliées et de glandes sudoripares.
Une nouvelle étude du Laboratoire de morphogénèse de l'Université Rockefeller, codirigée par Amy Shyer et Alan Rodrigues, révèle que des schémas de développement peuvent émerger spontanément des interactions physiques entre les collectifs cellulaires et la matrice qui les entoure. De telles interactions génèrent des propriétés fluides permettant la formation de motifs analogues à la façon dont un film d'eau sur le pare-brise se rétracte en gouttelettes.
En utilisant la peau de poulet comme système modèle, les chercheurs ont découvert que les forces mécaniques entre les cellules brisent la symétrie du tissu, poussant les cellules à s'agréger en faisceaux périodiquement espacés qui pousseront plus tard des plumes dans tout le tissu cutané. Ces changements structurels déclenchent des modifications secondaires de l'expression des gènes qui conduisent à une signalisation moléculaire classique, poussant le développement plus loin.
Les résultats, publiés dans Cell , permettent de mieux comprendre les facteurs physiques impliqués dans la formation des organes.
"Le développement d'organes implique une collaboration continue entre les processus mécaniques et moléculaires", explique la professeure adjointe Amy Shyer. "Comprendre la séquence précise des étapes de cette boucle de rétroaction pourrait nous aider à réparer les tissus ou à étudier la formation de tumeurs sous de nouveaux angles."
Structures montantes
Lorsque de nouveaux organes émergent d'un tissu embryonnaire homogène, ils semblent retirer la structure optimale de nombreuses possibilités. "L'une des choses mystérieuses à propos de ces structures est qu'elles ont un modèle parfait intégré qui maximise vraiment l'efficacité de leur fonction", explique Shyer.
Historiquement, les gènes ont obtenu une grande partie du crédit pour cet exploit d'ingénierie biologique. Ce sont nos gènes, pensait-on, qui fournissent une empreinte moléculaire qui détermine comment les cellules se spécialisent en composants spécifiques à un organe et comment elles se réorganisent pour donner naissance à des structures complexes. Mais certains scientifiques ont trouvé des raisons de remettre en question cette théorie. Par exemple, certaines structures se forment à une si grande échelle qu'il est difficile d'expliquer comment les signaux moléculaires supervisent la formation de motifs sur une si longue distance, laissant entendre que d'autres mécanismes doivent être en jeu.
Dans une perspective alternative, Shyer et Rodrigues se concentrent sur le rôle de la mécanique cellulaire collective dans la morphogenèse. Leurs travaux antérieurs ont montré que des changements morphologiques dans la peau des oiseaux apparaissent avant que les gènes impliqués dans la formation des follicules ne soient exprimés. "Ce ne sont donc pas nécessairement les gènes qui initient les premiers changements morphologiques", explique Rodrigues. "Au lieu de cela, nous avons constaté que les cellules s'auto-organisent pour initier des follicules. En même temps, nous ne connaissions pas le mécanisme précis qui permet cette auto-organisation."
Alignement collectif
Dans la nouvelle étude, l'équipe de Shyer et Rodrigues a entrepris d'examiner de plus près ce qui propulse exactement le tissu à changer. Pour zoomer sur les moments précédant la formation du motif, les chercheurs ont utilisé des cellules primaires de peau fraîchement prélevées sur des embryons de poulet et ajouté du collagène, un composant essentiel qui structure la peau. Ces deux ingrédients suffisaient pour que l'ensemble du processus se déroule dans un plat de laboratoire. Ce système a permis aux chercheurs de reconstruire le développement naturel de la peau tout en éliminant tout signal moléculaire potentiel des tissus voisins.
En observant le processus d'agrégation cellulaire image par image, Karl Palmquist, auteur principal de l'étude, a découvert que les cellules contractiles de la peau commençaient à s'attacher au substrat à base de collagène en forme de maille qui les entoure et à tirer dessus. Il a ensuite fait une observation clé :la force de traction de nombreuses cellules réaligne la matrice en une structure hautement ordonnée qui résiste à la traction. Les cellules, sentant la tension accrue, se contractent de plus en plus, augmentant leur traction. Finalement, les forces réciproques entre les cellules et la matrice extracellulaire génèrent un alignement collectif des cellules qui permet au champ de cellules de se transformer en un motif ordonné d'agrégats ressemblant à des follicules.
En collaboration avec Anna Erzberger, auteur principal qui était un ancien post-doctorant dans le laboratoire de James A. Hudspeth et est actuellement chef de groupe au Laboratoire européen de biologie moléculaire à Heidelberg, en Allemagne, l'équipe a développé un modèle théorique de développement de la peau basé sur le propriétés physiques des fluides. Ce modèle a prédit avec précision la formation spontanée d'agrégats multicellulaires réguliers.
L'équipe prévoit d'étudier comment des mécanismes multicellulaires similaires peuvent faire partie intégrante de la structuration d'autres tissus du corps au cours du développement et de la maladie.