La bactérie Neisseria gonorrhoeae pourrait avoir été à l'origine de l'évolution de variants génétiques humains qui protègent contre la démence. Crédit :Institut national des allergies et des maladies infectieuses, National Institutes of Health
Des chercheurs de la faculté de médecine de l'Université de Californie à San Diego ont précédemment découvert un ensemble de mutations génétiques humaines qui protègent les personnes âgées contre le déclin cognitif et la démence. Dans une nouvelle étude, publiée le 9 juillet 2022 dans Molecular Biology and Evolution , ils se concentrent sur l'un de ces gènes mutés et tentent de retracer son évolution - quand et pourquoi il est apparu dans le génome humain. Les résultats suggèrent que la pression sélective d'agents pathogènes infectieux comme la gonorrhée pourrait avoir favorisé l'émergence de cette variante de gène chez Homo sapiens et soutenu par inadvertance l'existence de grands-parents dans la société humaine.
La biologie de la plupart des espèces animales est optimisée pour la reproduction, souvent au détriment de la santé future et d'une durée de vie plus longue. En fait, les humains sont l'une des seules espèces connues à vivre bien après la ménopause. Selon "l'hypothèse de la grand-mère", cela s'explique par le fait que les femmes plus âgées apportent un soutien important à l'éducation des nourrissons et des enfants humains, qui nécessitent plus de soins que les jeunes des autres espèces. Les scientifiques essaient maintenant de comprendre quelles caractéristiques de la biologie humaine rendent possible cette santé à plus long terme.
Lorsque les chercheurs ont précédemment comparé les génomes humains et chimpanzés, ils ont découvert que les humains possédaient une version unique du gène du CD33, un récepteur exprimé dans les cellules immunitaires. Le récepteur CD33 standard se lie à un type de sucre appelé acide sialique dont toutes les cellules humaines sont recouvertes. Lorsque la cellule immunitaire détecte l'acide sialique via CD33, elle reconnaît l'autre cellule comme faisant partie du corps et ne l'attaque pas, empêchant une réponse auto-immune.
Le récepteur CD33 est également exprimé dans les cellules immunitaires du cerveau appelées microglie, où il aide à contrôler la neuroinflammation. Cependant, la microglie joue également un rôle important dans l'élimination des cellules cérébrales endommagées et des plaques amyloïdes associées à la maladie d'Alzheimer. En se liant aux acides sialiques sur ces cellules et plaques, les récepteurs CD33 réguliers suppriment en fait cette importante fonction microgliale et augmentent le risque de démence.
C'est là qu'intervient la nouvelle variante du gène. Quelque part le long de la ligne évolutive, les humains ont ramassé une forme mutée supplémentaire de CD33 qui manque du site de liaison au sucre. Le récepteur muté ne réagit plus aux acides sialiques sur les cellules et les plaques endommagées, permettant à la microglie de les décomposer. En effet, des niveaux plus élevés de cette variante de CD33 se sont avérés indépendamment protecteurs contre la maladie d'Alzheimer d'apparition tardive.
En essayant de comprendre quand cette variante génétique est apparue pour la première fois, le co-auteur principal Ajit Varki, MD, professeur émérite de médecine et de médecine cellulaire et moléculaire à l'École de médecine de l'UC San Diego, et ses collègues ont trouvé des preuves d'une forte sélection positive, suggérant que quelque chose conduisait le gène évolue plus rapidement que prévu. Ils ont également découvert que cette version particulière de CD33 n'était pas présente dans les génomes des Néandertaliens ou des Denisoviens, nos plus proches parents évolutifs.
"Pour la plupart des gènes qui sont différents chez les humains et les chimpanzés, les Néandertaliens ont généralement la même version que les humains, donc c'était vraiment surprenant pour nous", a déclaré Varki. "Ces découvertes suggèrent que la sagesse et les soins de grands-parents en bonne santé peuvent avoir été un avantage évolutif important que nous avions par rapport aux autres espèces d'hominidés anciennes."
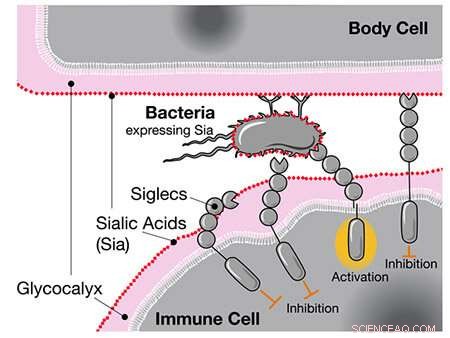
Lorsque les Siglecs comme CD33 détectent les acides sialiques humains, ils inhibent la réponse des cellules immunitaires, même si ces acides sont situés sur des bactéries. Crédit :UC San Diego Health Sciences
Varki a dirigé l'étude avec Pascal Gagneux, Ph.D., professeur de pathologie à l'École de médecine de l'UC San Diego et professeur au Département d'anthropologie. Les auteurs ont déclaré que l'étude fournit de nouvelles preuves à l'appui de l'hypothèse de la grand-mère.
Pourtant, la théorie de l'évolution affirme que le succès de la reproduction est le principal moteur de la sélection génétique, et non la santé cognitive post-reproductive. Alors, qu'est-ce qui poussait la prévalence de cette forme mutée de CD33 chez l'homme ?
Une possibilité, suggèrent les auteurs, est que des maladies hautement infectieuses comme la gonorrhée, qui peuvent nuire à la santé reproductive, aient pu avoir un impact sur l'évolution humaine. Les bactéries de la gonorrhée se recouvrent des mêmes sucres auxquels les récepteurs CD33 se lient. Comme un loup déguisé en mouton, la bactérie est capable de tromper les cellules immunitaires humaines pour ne pas les identifier comme des envahisseurs extérieurs.
Les chercheurs suggèrent que la version mutée de CD33 sans site de liaison au sucre est apparue comme une adaptation humaine contre un tel « mimétisme moléculaire » par la gonorrhée et d'autres agents pathogènes. En effet, ils ont confirmé qu'une des mutations spécifiques à l'homme était capable d'abolir complètement l'interaction entre la bactérie et le CD33, ce qui permettrait aux cellules immunitaires d'attaquer à nouveau la bactérie.
Dans l'ensemble, les auteurs pensent que les humains ont initialement hérité de la forme mutée de CD33 pour se protéger contre la gonorrhée pendant l'âge de procréer, et cette variante du gène a ensuite été cooptée par le cerveau pour ses avantages contre la démence.
"Il est possible que CD33 soit l'un des nombreux gènes sélectionnés pour leurs avantages de survie contre les agents pathogènes infectieux au début de la vie, mais qui sont ensuite sélectionnés en second lieu pour leurs effets protecteurs contre la démence et d'autres maladies liées au vieillissement", a déclaré Gagneux.
Les co-auteurs incluent Sudeshna Saha, Naazneen Khan, Andrea Verhagen, Aniruddha Sasmal et Sandra Diaz à l'UC San Diego; Troy Comi et Joshua M. Akey à l'Université de Princeton; Hai Yu et Xi Chen à UC Davis, et Martin Frank à Biognos AB.