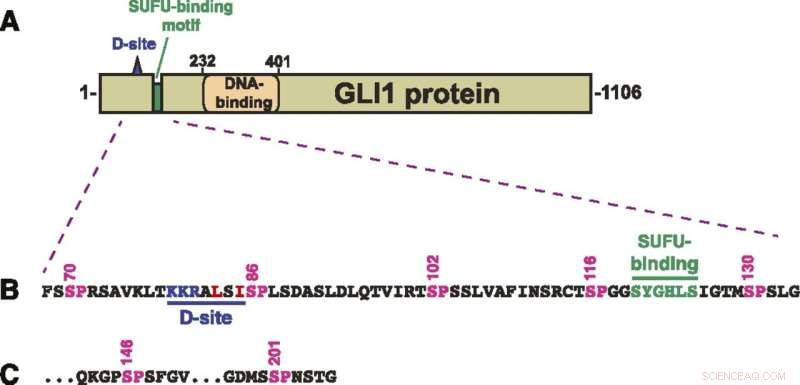
Structure de la protéine GLI1. (A) Schéma de la structure primaire de la protéine GLI1 humaine, montrant le site d'amarrage MAPK (site D), le motif de liaison SUFU et le domaine de liaison à l'ADN du doigt de zinc. Le domaine d'activation de la transcription constitue une grande partie de la moitié C-terminale de la protéine. (B) Séquence d'acides aminés des résidus 68 à 134, montrant le site D, le motif de liaison SUFU et un groupe de cinq sites de phosphorylation MAPK canoniques (SP). Les nombres ci-dessus montrent la position des résidus sérine dans les sites SP. (C) Les deux derniers des sept sites de phosphorylation SP MAPK contenus dans les résidus de 68-232 GLI1. Après S201, le site SP ou TP suivant se produit en S441. Crédit :A. Jane Bardwell et al, Life Science Alliance (2022). DOI :10.26508/lsa.202101353
De meilleurs traitements pour certaines des formes les plus meurtrières de cancer pourraient être plus proches grâce à une découverte dirigée par l'Université de Californie à Irvine sur la façon dont une certaine protéine est activée dans les cellules tumorales. La découverte, dirigée par des chercheurs de l'École des sciences biologiques, pourrait éventuellement conduire à des thérapies possibles pour le mélanome et l'adénocarcinome pancréatique particulièrement dangereux, ainsi que le type le plus courant de cancer du cerveau chez l'enfant et de cancer de la peau chez l'adulte. Un article décrivant le projet apparaît dans Life Science Alliance .
La découverte concerne la protéine GLI1, qui est importante dans le développement cellulaire mais qui s'est également avérée activée dans divers cancers. GLI1 est généralement activé par la voie de signalisation Hedgehog, connue sous le nom de HH. Cependant, les scientifiques savent depuis environ une décennie que la diaphonie (interaction) entre l'HH et la voie de la protéine kinase activée par les mitogènes joue un rôle dans les cancers.
"Dans certains cas, les protéines d'une voie peuvent activer les protéines d'une autre", a déclaré l'auteur principal A. Jane Bardwell, scientifique du projet au Département de biologie du développement et cellulaire de l'UCI. "C'est un système complexe. Nous voulions comprendre le mécanisme moléculaire qui conduit à l'activation de GLI1 par les protéines de la voie MAPK."
GLI1 se lie normalement étroitement avec une protéine appelée SUFU. Cette protéine supprime GLI1, l'empêchant de pénétrer dans les noyaux cellulaires et d'activer les gènes. Les scientifiques ont examiné sept sites sur la protéine GLI1 qui pourraient être phosphorylés ou sur lesquels un groupe phosphate pourrait être transféré.
"Nous en avons identifié trois qui peuvent être phosphorylées et qui sont impliquées dans l'affaiblissement de la liaison entre GLI1 et SUFU", a déclaré Lee Bardwell, professeur de biologie du développement et cellulaire, dont le laboratoire a mené le projet. "Ce processus active GLI1, lui permettant d'entrer dans le noyau des cellules, où il peut provoquer une croissance incontrôlée entraînant un cancer."
Il a noté que la phosphorylation des trois sites provoque un niveau significativement plus élevé d'échappement de GLI1 de SUFU que si seulement un ou même deux d'entre eux recevaient des groupes phosphate.
Cette découverte est une étape importante vers des traitements contre le cancer plus efficaces et personnalisés. "Si nous pouvons comprendre exactement ce qui se passe dans un certain cancer ou une tumeur particulière, il pourrait être possible de développer un médicament spécifique à une tumeur spécifique ou à un patient particulier", a déclaré Bardwell. "Cela nous permettrait de traiter ces maladies sans la toxicité de la chimiothérapie de base." De plus, de nombreuses tumeurs du même cancer présentent des mutations différentes d'un individu à l'autre. À terme, il sera peut-être possible de dépister les tumeurs afin de développer la meilleure approche pour chacune.
La recherche a été réalisée en collaboration avec le département de microbiologie et de génétique moléculaire de l'École de médecine de l'UCI et le département de dermatologie de l'École de médecine de l'Université de Stanford.