
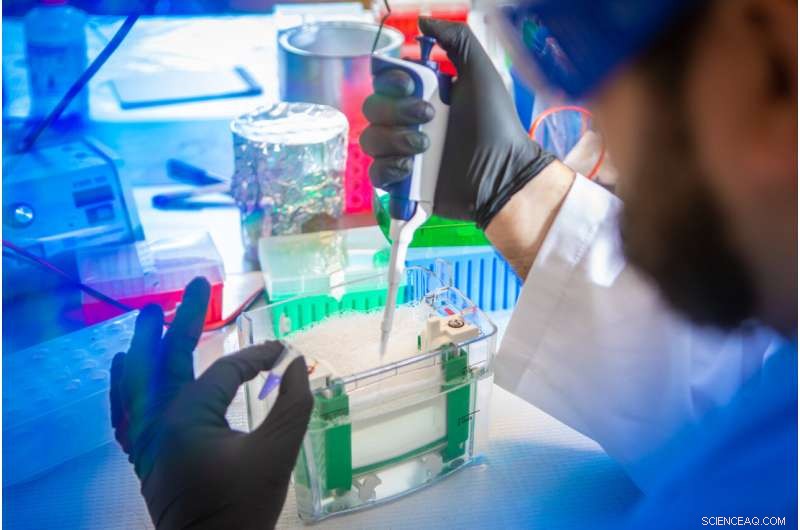
Petar Pajic, doctorant à l'UB en sciences biologiques, prépare un échantillon de salive pour la séparation et l'analyse. Dans la nouvelle étude, l'équipe a utilisé une technique d'électrophorèse sur gel pour séparer les mucines des autres protéines dans la salive de divers mammifères. Crédit :Douglas Levere / Université de Buffalo
Des limaces de revêtement visqueux à la salive dans nos bouches, de nombreux fluides corporels glissants contiennent du mucus. Alors, comment cette merveille de la biologie a-t-elle évolué ?
Chez les mammifères, la réponse est plusieurs fois, et souvent de manière surprenante, selon une nouvelle étude sur des protéines appelées mucines. Ces molécules ont diverses fonctions, mais en tant que famille, elles sont connues comme composants du mucus, où elles contribuent à la consistance gluante de la substance.
Grâce à une comparaison des gènes de la mucine chez 49 espèces de mammifères, les scientifiques ont identifié 15 cas dans lesquels de nouvelles mucines semblent avoir évolué via un processus additif qui a transformé une protéine non mucine en mucine.
Les scientifiques proposent que chacun de ces événements de "mucinisation" ait commencé avec une protéine qui n'était pas une mucine. À un moment donné, l'évolution a ajouté une nouvelle section à cette base non mucine :une section constituée d'une courte chaîne de blocs de construction appelés acides aminés qui sont décorés de molécules de sucre. Au fil du temps, cette nouvelle région s'est dupliquée, avec plusieurs copies ajoutées pour allonger encore plus la protéine, ce qui en fait une mucine.
Les régions doublées, appelées "répétitions", sont essentielles à la fonction d'une mucine, affirment les chercheurs de l'Université de Buffalo, Omer Gokcumen et Stefan Ruhl, les auteurs principaux de l'étude, et Petar Pajic, le premier auteur.
Les sucres recouvrant ces sections font saillie vers l'extérieur comme les poils d'un goupillon, et ils confèrent aux mucines la propriété visqueuse qui est vitale pour de nombreuses tâches importantes que ces protéines accomplissent.
La recherche sera publiée le 26 août dans Science Advances.
Fioles de salive prélevées sur divers mammifères, dont un porc. Crédit :Douglas Levere / Université de Buffalo
"Je ne pense pas que l'on sache auparavant que la fonction protéique peut évoluer de cette façon, à partir d'une protéine gagnant des séquences répétées. Une protéine qui n'est pas une mucine devient une mucine simplement en gagnant des répétitions. C'est un moyen important par lequel l'évolution fait de la boue . C'est une astuce évolutive, et nous documentons maintenant ce qui se passe encore et encore", déclare Gokcumen, Ph.D., professeur agrégé de sciences biologiques à l'UB College of Arts and Sciences.
"Les répétitions que nous voyons dans les mucines sont appelées" répétitions PTS "pour leur teneur élevée en acides aminés proline, thréonine et sérine, et elles aident les mucines dans leurs fonctions biologiques importantes qui vont de la lubrification et de la protection des surfaces des tissus à rendre nos aliments glissants. afin que nous puissions l'avaler », explique Stefan Ruhl, DDS, Ph.D., doyen par intérim de l'École de médecine dentaire de l'UB et professeur de biologie buccale. "Les microbes bénéfiques ont évolué pour vivre sur des surfaces recouvertes de mucus, tandis que le mucus peut en même temps agir comme une barrière protectrice et se défendre contre les maladies en nous protégeant des intrus pathogènes indésirables."
"Peu de gens savent que la première mucine qui a été purifiée et caractérisée biochimiquement provient d'une glande salivaire", ajoute Ruhl. "Mon laboratoire étudie les mucines dans la salive depuis 30 ans, principalement parce qu'elles protègent les dents de la carie et parce qu'elles aident à équilibrer le microbiote dans la cavité buccale."
The intriguing evolution of an 'amazing life trait'
"I think this paper is really interesting," Gokcumen says. "It's one of those times where we got lucky. We were studying saliva, and then we found something that's interesting and cool and decided to look into it."
While studying saliva, the team noticed that a small salivary mucin in humans called MUC7 was not present in mice. The rodents did, however, have a similarly sized salivary mucin called MUC10. The scientists wanted to know:Were these two proteins related from an evolutionary perspective?
The answer was no. But what the research uncovered next was a surprise. While MUC10 did not appear to be related to MUC7, a protein found in human tears called PROL1 did share a portion of MUC10's structure. PROL1 looked a lot like MUC10, minus the sugar-coated bottlebrush repeats that make MUC10 a mucin.
Petar Pajic, UB PhD student in biological sciences, uses a gel electrophoresis technique to separate mucins from other proteins in a saliva sample. Credit:Douglas Levere / University at Buffalo
"We think that somehow that tear gene ends up repurposed," Gokcumen says. "It gains the repeats that give it the mucin function, and it's now abundantly expressed in mouse and rat saliva."
The scientists wondered whether other mucins might have formed the same way. They began to investigate and discovered multiple examples of the same phenomena. Though many mucins share common ancestry among various groups of mammals, the team documented 15 instances in which evolution appeared to have converted non-mucin proteins into mucins via the addition of PTS repeats.
And this was "with a pretty conservative look," Gokcumen says, noting that the study focused on one region of the genome in a few dozen mammal species. He calls slime an "amazing life trait," and he's curious whether the same evolutionary mechanism might have driven the formation of some mucins in slugs, slime eels and other critters. More research is needed to find an answer.
"How new gene functions evolve is still a question we are asking today," says Pajic, a UB Ph.D. student in biological sciences. "Thus, we are adding to this discourse by providing evidence of a new mechanism, where gaining repeated sequences within a gene births a novel function."
"I think this could have even broader implications, both in understanding adaptive evolution and in possibly explaining certain disease-causing variants," Pajic adds. "If these mucins keep evolving from non-mucins over and over again in different species at different times, it suggests that there is some sort of adaptive pressure that makes it beneficial. And then, at the other end of the spectrum, maybe if this mechanism goes 'off the rails'—happening too much, or in the wrong tissue—then maybe it can lead to disease like certain cancers or mucosal illnesses."
The study on mucins demonstrates how a long-time partnership between evolutionary biologists and dental researchers at UB is yielding new insights into genes and proteins that are also important to human health.
"My team has been studying mucins for many decades, and my collaboration with Dr. Gokcumen has brought this research to a new level by revealing all these exciting novel insights into their evolutionary genetics," Ruhl says. "At this advanced stage of my career, it is also immensely gratifying to see that the flame of scientific curiosity is being carried on by a new generation of young investigators like Petar Pajic." Contact lenses:A molecule from pig stomach mucus prevents corneal damage