Crédit :Katsutoshi Nagaoka
(Phys.org)—L'hydrogène a le potentiel de fournir une alternative, source d'énergie propre, particulièrement appliqué à la technologie des piles à combustible. Les sources de combustibles actuelles impliquent des combustibles fossiles contenant du carbone ou des molécules organiques contenant du carbone, qui se traduisent par la production de CO en excès
L'initiative Energy Carriers au Japon est un projet national qui examine spécifiquement les moyens de stocker et de transporter efficacement l'hydrogène. Une façon d'y parvenir est d'utiliser l'ammoniac comme source d'hydrogène. Cependant, la découverte d'un procédé efficace pour décomposer l'ammoniac s'est avérée difficile, en grande partie parce que le processus catalytique pour décomposer l'ammoniac nécessite l'ajout continu de chaleur, ce qui peut être prohibitif.
Katsutoshi Nagaoka, Takaaki Eboshi, Yuma Takeishi, Ryô Tasaki, Honda de Kyoto, Kazuya Imamura, et Katsutoshi Sato de l'Université d'Oita au Japon ont développé une méthode utilisant un nouveau catalyseur pour produire de l'hydrogène à partir d'ammoniac sans ajout de chaleur externe par le biais du cycle catalytique. Leur travail apparaît dans Avancées scientifiques .
La décomposition de l'ammoniac en hydrogène et azote est un processus endothermique, ce qui signifie qu'il nécessite l'ajout d'énergie pour obtenir des produits. Cela signifie que les réactions de décomposition catalytique traditionnelles nécessitent l'ajout d'une grande quantité de chaleur pour obtenir une quantité utile d'hydrogène gazeux.
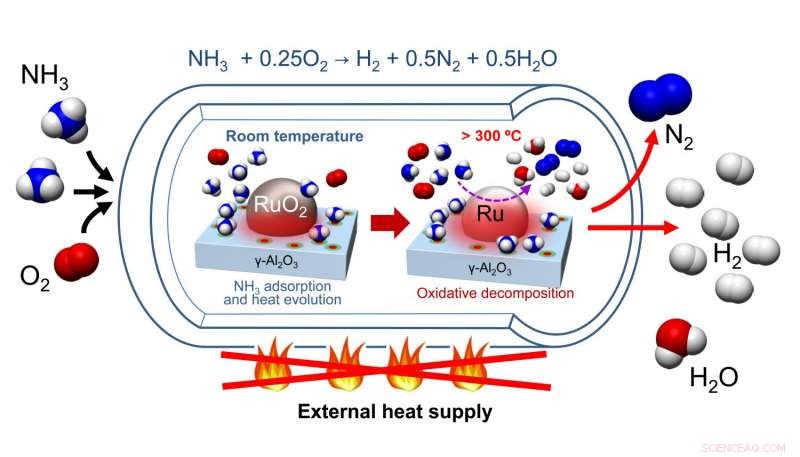
Nagaoka et al. développé un catalyseur composé d'un RuO
Le prétraitement du catalyseur a nécessité un chauffage pour éliminer l'eau et le dioxyde de carbone, mais il n'a pas nécessité de réchauffage ultérieur. Des tests sur le cyclage du catalyseur ont montré qu'après le prétraitement initial du RuO
Dans un effort pour comprendre comment la RuO
Les auteurs soulignent que cette différence de température d'adsorption est probablement due à l'interaction favorable entre l'ammoniac, une molécule basique, et Al
En outre, les auteurs ont examiné la différence entre l'utilisation de γ-Al nu
Globalement, ce type de catalyseur est utile pour fournir suffisamment de chaleur pour surmonter les besoins en chaleur nécessaires à la décomposition endothermique de l'ammoniac en hydrogène et azote gazeux. Cette étude montre que la catalyse auto-échauffante est une option viable pour explorer des solutions aux difficultés pratiques liées à l'utilisation de l'ammoniac comme source d'hydrogène.
© 2017 Phys.org