
Une mouche des fruits Drosophila melanogaster implantée (premier plan) interagissant avec une mouche intacte (arrière-plan). Crédit :Alain Herzog (EPFL)
Des scientifiques de l'EPFL ont mis au point une technique d'implantation qui permet un accès optique sans précédent à la "moelle épinière" de la mouche des fruits, Drosophila melanogaster. Ces travaux peuvent potentiellement conduire à des percées dans les domaines des neurosciences, de l'intelligence artificielle et de la robotique bio-inspirée.
Comprendre le contrôle moteur biologique nécessite la capacité d'enregistrer l'activité neuronale pendant que les animaux se comportent", explique le professeur Pavan Ramdya de la Faculté des sciences de la vie de l'EPFL. "Nous avons un milliard de neurones dans la moelle épinière humaine - un système massif - et nous ne pouvons pas manipuler neurones chez un humain comme nous le pouvons chez les animaux. La drosophile, la mouche des fruits, est un très petit organisme dans lequel on peut manipuler génétiquement et imager l'activité de presque tout le circuit moteur chez les animaux qui se comportent."
Pendant des années, les recherches de Ramdya se sont concentrées sur la récapitulation numérique des principes sous-jacents au contrôle moteur de la drosophile. En 2019, son groupe a publié DeepFly3D, un logiciel de capture de mouvement basé sur l'apprentissage en profondeur qui utilise plusieurs vues de caméra pour quantifier les mouvements 3D des membres des mouches qui se comportent. En 2021, l'équipe de Ramdya a révélé LiftPose3D, une méthode de reconstruction de poses d'animaux 3D à partir d'images 2D prises à partir d'une seule caméra. Ces efforts ont été complétés par sa publication en 2022 de NeuroMechFly, un premier "jumeau" numérique morphologiquement précis de la Drosophile.
Mais il y a toujours plus de défis à relever, en particulier dans ce domaine qui se situe à l'interface entre la biologie, les neurosciences, l'informatique et la robotique. L'objectif n'est pas seulement de cartographier et de comprendre le système nerveux d'un organisme, une tâche ambitieuse en soi, mais aussi de découvrir comment développer des robots bio-inspirés aussi agiles que des mouches.
"L'obstacle que nous rencontrions avant ce travail", explique Ramdya, "était que nous ne pouvions enregistrer les circuits des moteurs des mouches que pendant une courte période avant que la santé de l'animal ne se détériore."
Par conséquent, Ramdya s'est associé au professeur Selman Sakar de la Faculté d'ingénierie de l'EPFL pour développer des outils permettant de surveiller l'activité neuronale de la drosophile pendant de plus longues périodes, jusqu'à la durée de vie entière de l'insecte. Ce projet a été dirigé par Laura Hermans, titulaire d'un doctorat. étudiant qui a été co-supervisé par Ramdya et Sakar.
Une fenêtre sur le cordon nerveux ventral
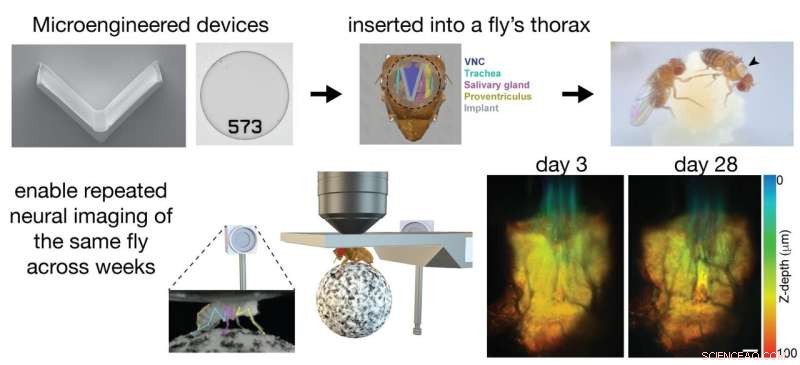
"Nous avons développé des dispositifs de micro-ingénierie qui fournissent un accès optique au cordon nerveux ventral de l'animal", explique Herman, faisant référence à l'équivalent de la moelle épinière chez la mouche. "Nous avons ensuite implanté chirurgicalement ces dispositifs dans le thorax de la mouche", poursuit-elle. "L'un de ces dispositifs, un implant, nous permet d'écarter les organes de la mouche pour révéler le cordon nerveux ventral en dessous. Nous scellons ensuite le thorax avec une fenêtre microfabriquée transparente. Une fois que nous avons des mouches avec ces dispositifs, nous pouvons enregistrer le comportement de la mouche ainsi que son activité neuronale à travers un large éventail d'expériences sur de longues périodes."
Le but derrière tous ces outils est de permettre aux scientifiques d'observer un animal individuel sur de longues périodes de temps. Ils peuvent désormais réaliser des expériences qui s'étendent au-delà de quelques heures seulement et peuvent même couvrir toute la durée de vie de la mouche. "Par exemple, nous pouvons étudier comment la biologie d'un animal s'adapte au cours de la progression de la maladie", explique Hermans. "Nous pouvons également étudier les changements dans l'activité et la structure des circuits neuronaux au cours du vieillissement. Le cordon nerveux ventral de la mouche est idéal car il héberge les circuits moteurs de l'animal, ce qui nous permet d'étudier l'évolution de la locomotion dans le temps ou après une blessure."
L'implant
"En tant qu'ingénieurs, nous aspirons à des défis techniques aussi bien définis", déclare Selman Sakar. "Le groupe de Pavan a mis au point une technique de dissection pour retirer de la mouche les organes qui bloquent le champ de vision et visualiser le cordon nerveux ventral. Cependant, les mouches ne peuvent survivre que quelques heures après la chirurgie. Nous étions convaincus qu'un implant a à placer dans le thorax. Il existe des techniques analogues pour visualiser le système nerveux d'animaux plus gros comme les rats. Nous nous sommes inspirés de ces solutions et avons commencé à réfléchir à la question de la miniaturisation."
Les premiers prototypes ont tenté de relever le défi consistant à déplacer et à retenir en toute sécurité les organes de la mouche pour découvrir le cordon nerveux ventral, tout en permettant à la mouche de survivre après l'opération.
La procédure chirurgicale par laquelle le nouvel implant en forme de V est inséré dans le thorax de la drosophile pour permettre un accès optique à son cordon nerveux ventral. Crédit :Laura Hermans (EPFL)
"Pour ce défi, vous avez besoin de quelqu'un qui peut aborder un problème avec une perspective à la fois des sciences de la vie et de l'ingénierie - cela souligne l'importance du travail de Laura [Hermans] et de Murat [Kaynak]", déclare Sakar.
Les premiers implants étaient rigides et très peu de mouches ont survécu à la procédure. Essayer d'améliorer les taux de survie sans sacrifier la qualité de l'imagerie a posé un défi qui a nécessité plusieurs itérations de conception. En fin de compte, le gagnant était un prototype simple mais efficace :un implant conforme en forme de V qui peut écarter en toute sécurité les organes de la mouche, découvrir le cordon ventral et permettre aux chercheurs de sceller le trou sur la cuticule avec un "code-barres thoracique". fenêtre", ce qui leur permet d'observer le cordon nerveux ventral et de mesurer l'activité neuronale au cours de la vie quotidienne de la mouche.
"Compte tenu des variations anatomiques d'un animal à l'autre, nous avons dû trouver une solution sûre et adaptative", explique Sakar. "Notre implant répond à ce besoin particulier. Associé au développement d'outils de micromanipulation tissulaire appropriés et d'une étape conforme à la nanoimpression 3D pour le montage d'animaux lors de sessions d'imagerie répétées, nous fournissons une boîte à outils polyvalente complète pour la recherche en neurosciences."
Une route ouverte
La réalisation est un exemple de la recherche ouverte et interdisciplinaire typique de l'EPFL. "Depuis le premier jour, nous avons été très ouverts au partage de la technologie", déclare Sakar. "L'idée ici est de diffuser rapidement les outils et les méthodes afin que nous puissions faciliter à la fois le développement ultérieur de la technologie et le processus de découverte qu'ils offrent dans de nombreux domaines de recherche. Un certain nombre de groupes aimeraient, je pense, explorer notre technologie. ."
"En étudiant la mouche, nous pensons que comprendre quelque chose de relativement simple peut jeter les bases de la compréhension d'organismes plus compliqués", explique Ramdya. "Lorsque vous apprenez les mathématiques, vous ne plongez pas dans l'algèbre linéaire ; vous apprenez d'abord à additionner et à soustraire. De plus, pour la robotique, ce serait fantastique de comprendre comment fonctionne même un "simple" insecte."
La prochaine étape pour l'équipe est d'utiliser leur nouvelle méthodologie pour démêler les mécanismes de contrôle des mouvements de la drosophile. "Les systèmes biologiques sont vraiment uniques par rapport aux systèmes artificiels en ce sens qu'ils peuvent moduler dynamiquement, par exemple, l'excitabilité des neurones ou la force des synapses", ajoute Ramdya. "Ainsi, pour comprendre ce qui rend les systèmes biologiques si agiles, il faut être capable d'observer ce dynamisme. Dans notre cas, nous aimerions voir comment, par exemple, les systèmes moteurs réagissent au cours de la vie d'un animal au vieillissement ou pendant récupération suite à une blessure."
L'étude actuelle est publiée dans Nature Communications . Une nouvelle technique révèle le contrôle des membres chez les mouches et peut-être les robots