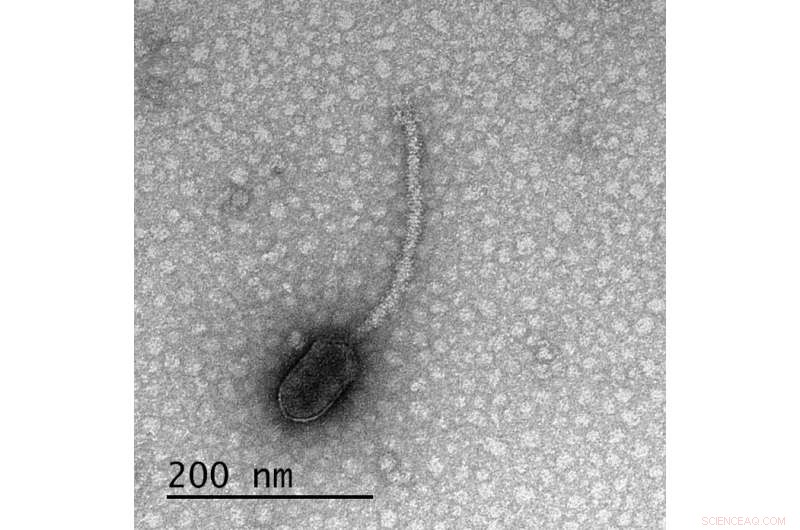
Un bactériophage delta, le premier identifié dans une nouvelle étude dans Frontiers in Microbiology avoir des sites de liaison pour CtrA, une protéine produite par l'hôte du bactériophage qui régule la production de pili et de flagelles. La présence de ces sites de liaison uniquement dans les phages qui nécessitent que leurs cellules hôtes aient des pili/flagelles pour les infecter suggère que le phage surveille la présence de cette protéine afin de « décider » de rester sur place ou de se répliquer et d'émerger de sa cellule hôte. Crédit :Tagide de Carvalho/UMBC
Nouvelle recherche dirigée par l'UMBC sur Frontiers in Microbiology suggère que les virus utilisent les informations de leur environnement pour "décider" quand rester assis à l'intérieur de leurs hôtes et quand se multiplier et éclater, tuant la cellule hôte. Le travail a des implications pour le développement de médicaments antiviraux.
La capacité d'un virus à détecter son environnement, y compris les éléments produits par son hôte, ajoute "une autre couche de complexité à l'interaction virus-hôte", explique Ivan Erill, professeur de sciences biologiques et auteur principal du nouvel article. À l'heure actuelle, les virus exploitent cette capacité à leur avantage. Mais à l'avenir, dit-il, "nous pourrions l'exploiter à leur détriment".
Ce n'est pas une coïncidence
La nouvelle étude s'est concentrée sur les bactériophages, des virus qui infectent les bactéries, souvent appelés simplement "phages". Les phages de l'étude ne peuvent infecter leurs hôtes que lorsque les cellules bactériennes ont des appendices spéciaux, appelés pili et flagelles, qui aident les bactéries à se déplacer et à s'accoupler. Les bactéries produisent une protéine appelée CtrA qui contrôle le moment où elles génèrent ces appendices. Le nouvel article montre que de nombreux phages dépendants des appendices ont des motifs dans leur ADN où la protéine CtrA peut se fixer, appelés sites de liaison. Un phage ayant un site de liaison pour une protéine produite par son hôte est inhabituel, dit Erill.
Encore plus surprenant, Erill et le premier auteur de l'article, Elia Mascolo, titulaire d'un doctorat. étudiant dans le laboratoire d'Erill, a découvert grâce à une analyse génomique détaillée que ces sites de liaison n'étaient pas uniques à un seul phage, ni même à un seul groupe de phages. De nombreux types de phages différents avaient des sites de liaison CtrA, mais ils exigeaient tous que leurs hôtes aient des pili et/ou des flagelles pour les infecter. Ce ne pouvait pas être une coïncidence, ont-ils décidé.
La capacité de surveiller les niveaux de CtrA "a été inventée à plusieurs reprises au cours de l'évolution par différents phages qui infectent différentes bactéries", explique Erill. Lorsque des espèces éloignées présentent un trait similaire, on parle d'évolution convergente, et cela indique que le trait est définitivement utile.
Le timing est primordial
Une autre faille dans l'histoire :le premier phage dans lequel l'équipe de recherche a identifié des sites de liaison CtrA infecte un groupe particulier de bactéries appelées Caulobacterales. Les caulobactéries sont un groupe de bactéries particulièrement bien étudié, car elles existent sous deux formes :une forme « grouillante » qui nage librement et une forme « pédonculée » qui se fixe à une surface. Les essaims ont des pili/flagelles, et les tiges n'en ont pas. Chez ces bactéries, CtrA régule également le cycle cellulaire, déterminant si une cellule se divisera uniformément en deux autres cellules du même type, ou se divisera de manière asymétrique pour produire une cellule fourmillante et une cellule tige.
Étant donné que les phages ne peuvent infecter que les cellules essaimeuses, il est dans leur intérêt de ne sortir de leur hôte que lorsqu'il existe de nombreuses cellules essaimeuses disponibles pour infecter. Généralement, les Caulobacterales vivent dans des environnements pauvres en nutriments et sont très dispersées. "Mais lorsqu'ils trouvent une bonne poche de microhabitat, ils deviennent des cellules pédonculées et prolifèrent", explique Erill, produisant finalement de grandes quantités de cellules essaimeuses.
Ainsi, "Nous supposons que les phages surveillent les niveaux de CtrA, qui montent et descendent au cours du cycle de vie des cellules, pour déterminer quand la cellule essaimeuse devient une cellule tige et devient une usine d'essaims", dit Erill, "et à ce moment-là, ils font éclater la cellule, car il y aura de nombreux essaims à proximité à infecter."
À l'écoute
Malheureusement, la méthode pour prouver cette hypothèse est laborieuse et extrêmement difficile, donc cela ne faisait pas partie de ce dernier article, bien qu'Erill et ses collègues espèrent aborder cette question à l'avenir. Cependant, l'équipe de recherche ne voit aucune autre explication plausible à la prolifération des sites de liaison CtrA sur autant de phages différents, qui nécessitent tous des pili/flagelles pour infecter leurs hôtes. Encore plus intéressantes, notent-ils, sont les implications pour les virus qui infectent d'autres organismes, même les humains.
"Tout ce que nous savons sur les phages, chaque stratégie évolutive qu'ils ont développée, s'est avéré se traduire par des virus qui infectent les plantes et les animaux", dit-il. "C'est presque une évidence. Donc, si les phages écoutent leurs hôtes, les virus qui affectent les humains feront de même."
Il existe quelques autres exemples documentés de phages surveillant leur environnement de manière intéressante, mais aucun n'inclut autant de phages différents employant la même stratégie contre autant d'hôtes bactériens.
Cette nouvelle recherche est la "première démonstration à grande échelle que les phages écoutent ce qui se passe dans la cellule, dans ce cas, en termes de développement cellulaire", a déclaré Erill. Mais d'autres exemples sont en route, prédit-il. Déjà, les membres de son laboratoire ont commencé à chercher des récepteurs pour d'autres molécules bactériennes régulatrices dans les phages, dit-il, et ils les trouvent.
Nouvelles pistes thérapeutiques
La principale conclusion de cette recherche est que "le virus utilise les informations cellulaires pour prendre des décisions", dit Erill, "et si cela se produit dans les bactéries, cela se produit presque certainement dans les plantes et les animaux, car s'il s'agit d'une stratégie évolutive qui a du sens, l'évolution le découvrira et l'exploitera."
Par exemple, pour optimiser sa stratégie de survie et de réplication, un virus animal peut vouloir savoir dans quel type de tissu il se trouve ou quelle est la robustesse de la réponse immunitaire de l'hôte à son infection. Bien qu'il puisse être troublant de penser à toutes les informations que les virus pourraient collecter et éventuellement utiliser pour nous rendre plus malades, ces découvertes ouvrent également la voie à de nouvelles thérapies.
"Si vous développez un médicament antiviral et que vous savez que le virus écoute un signal particulier, vous pouvez peut-être tromper le virus", déclare Erill. C'est à quelques pas, cependant. Pour l'instant, "nous commençons à peine à réaliser à quel point les virus nous regardent activement, comment ils surveillent ce qui se passe autour d'eux et prennent des décisions en fonction de cela", déclare Erill. "C'est fascinant." Certains microbes attendent que leurs hôtes leur donnent sans le savoir le signal de commencer à se multiplier et de les tuer