Résumé graphique. Crédit :Cellule de développement (2022). DOI :10.1016/j.devcel.2022.09.004
"Ce que nos travaux montrent, c'est comment un complexe au centre de la cellule, la région d'interaction ER-Golgi, contrôle le cholestérol de la membrane plasmique, qui est essentiel pour de nombreuses fonctions cellulaires, voire essentiel pour la vie multicellulaire", explique le professeur Gisou van der Goot. à la Faculté des sciences de la vie de l'EPFL. Son groupe, en collaboration avec le groupe de Giovanni D'Angelo à l'EPFL, a publié une étude dans Developmental Cell qui découvre comment les agents pathogènes exploitent un processus cellulaire clé pour intoxiquer les cellules.
Étant donné que les agents pathogènes ont évolué pour détourner de nombreux processus cellulaires de leurs hôtes, l'étude des interactions hôte-pathogène nous aide à mieux comprendre les processus biologiques fondamentaux. Ici, les scientifiques ont découvert que l'interaction entre deux organites clés de la cellule, le réticulum endoplasmique et l'appareil de Golgi, est essentielle pour contrôler quels lipides se trouvent au niveau de la membrane cellulaire. Les deux organites jouent un rôle essentiel dans la synthèse de nouvelles protéines et leur transport dans la cellule.
Les chercheurs ont entrepris de découvrir quelles protéines sont importantes pour que la toxine de la bactérie de l'anthrax Bacillus anthracis pénètre dans la cellule. Pour ce faire, ils ont criblé une banque de 1500 gènes normalement impliqués dans l'organisation des organites de la cellule ainsi que de sa membrane.
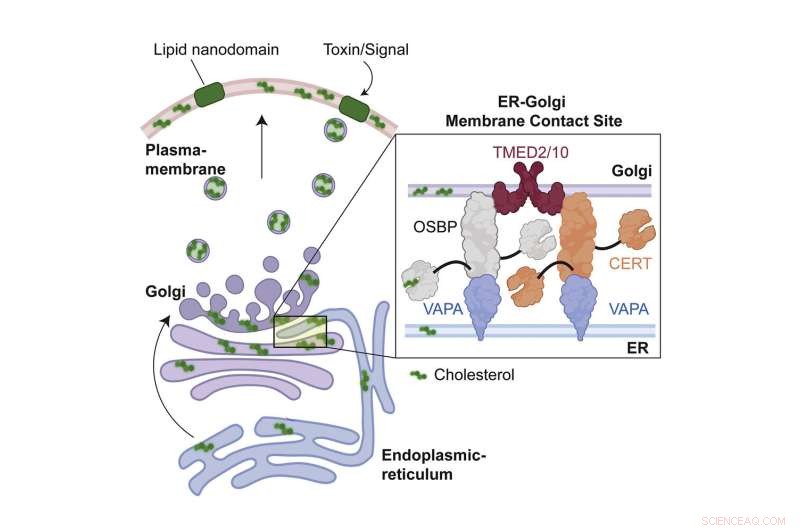
Infection au charbon et sites de contact ER-Golgi
La toxine du charbon est composée de trois sous-unités, un antigène protecteur qui lui permet de se lier aux récepteurs de la cellule cible, et de deux sous-unités enzymatiques, le facteur létal et le facteur œdème, qui causent réellement des dommages à la cellule.
Lorsqu'il est sécrété, l'antigène protecteur se lie à deux récepteurs sur la membrane cellulaire. Il est ensuite découpé par la furine, une enzyme, et s'associe enfin à d'autres antigènes protecteurs pour former un pore. Ce pore permet aux facteurs létaux et oedémateux de pénétrer dans la cellule, où ils font des ravages. Bien que ce processus soit assez bien cartographié, nous ne savons pas quelles molécules au sein de la cellule facilitent toutes ses étapes.
De l'anthrax à la découverte biologique
Les données des gènes criblés ont atterri sur deux gènes et leurs protéines, appelés TMED2 et TMED10, tous deux situés sur les sites de contact ER-Golgi, un emplacement très inattendu lors de l'étude d'une toxine qui provient de l'extérieur de la cellule.
Lorsque les scientifiques ont régulé négativement les gènes de TMED2 et TMED10, la toxine de l'anthrax a perdu sa capacité à former des pores. En outre, une analyse approfondie a révélé quelque chose de nouveau en termes de biologie cellulaire de base :que les deux protéines organisent de grands supercomplexes protéiques au niveau des sites de contact de la membrane ER-Golgi, qui sont responsables du transfert de cholestérol entre les deux organites. Si ce transfert ne se produit pas, le cholestérol n'atteint jamais la membrane de la cellule et est plutôt stocké dans des gouttelettes de graisse.
"Dans l'ensemble, cette étude de l'intoxication à l'anthrax a conduit à la découverte que le remodelage de la composition lipidique aux interfaces ER-Golgi contrôle entièrement la formation de nanodomaines membranaires fonctionnels à la surface des cellules", concluent les auteurs de l'étude. Jusqu'à la surface cellulaire et au-delà :tracer le transport sous-cellulaire de la glycoprotéine à l'aide de la toxine cholérique modifiée