Crédit :Samar A. Mahmoud et al, Cell Reports (2022). DOI :10.1016/j.celrep.2022.111405
Dans une nouvelle recherche récemment publiée dans la revue Cell Reports , une équipe de scientifiques de l'Université du Massachusetts à Amherst a exploré les mystères de la façon dont les cellules résistent au stress. En utilisant des cellules bactériennes, les chercheurs ont découvert qu'une enzyme réparatrice des dommages, appelée ClpX, peut non seulement muter pour résoudre plusieurs problèmes cellulaires, mais peut également répondre aux changements de niveaux d'énergie cellulaire pour aider à maintenir une cellule en bonne santé.
"Ce qui nous intéresse vraiment", déclare Peter Chien, professeur de biochimie et de biologie moléculaire à l'UMass Amherst et auteur principal de l'article, "c'est la façon dont les cellules réagissent au stress. Nous étudions une classe d'enzymes, appelées protéases, qui ciblent et détruire les protéines nocives à l'intérieur d'une cellule. Ces protéases peuvent reconnaître sélectivement des protéines individuelles spécifiques. Mais comment font-elles cela ? Comment peuvent-elles choisir entre des protéines saines et des protéines nocives ?"
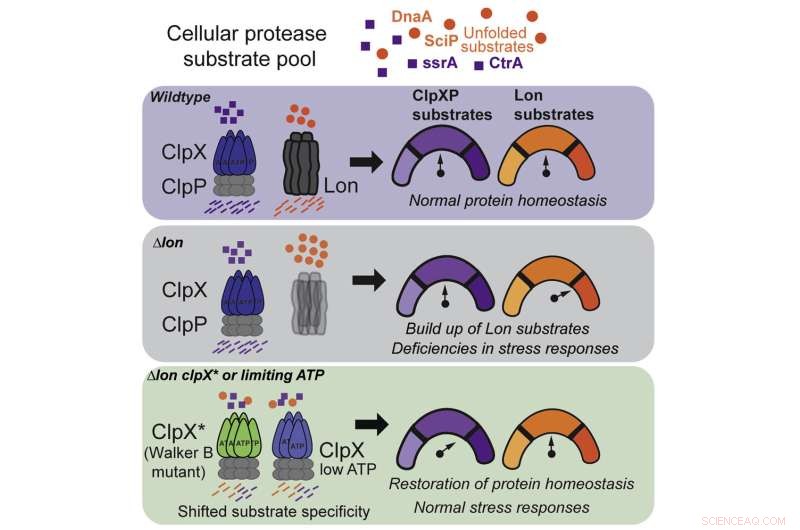
Pour répondre à cette question, Chien et ses co-auteurs se sont concentrés sur deux protéases spécifiques, connues sous le nom de Lon et ClpX, chacune étant parfaitement adaptée pour reconnaître une protéine nocive différente. On a longtemps pensé que Lon et ClpX fonctionnaient comme des clés :chacun ne pouvait ouvrir qu'une serrure spécifique et aucune autre, et si une cellule en manquait, de graves effets secondaires se produiraient.
"Si vous avez déjà eu un colocataire d'université extrêmement désordonné", déclare Chien, "vous savez à quel point il est important de vider la poubelle régulièrement. Manquer la protéase Lon, c'est comme avoir un colocataire qui ne se lave, ne se change ou ne nettoie jamais."
Mais, après une série d'expériences impliquant la suppression de Lon de colonies de cellules bactériennes, l'équipe de Chien a commencé à remarquer quelque chose d'étrange :certaines colonies survivaient.
Cette observation a conduit à leur première découverte :ClpX peut muter pour exécuter une fonction de type Lon, bien qu'il perde certaines de ses capacités ClpX. C'est comme si, pour garder votre dortoir propre, vous commenciez à laver les chaussettes de votre colocataire, mais que vous deviez sacrifier une partie de votre linge propre pour le faire.
En traçant exactement comment la mutation ClpX a permis à la protéase d'étendre sa fonction, l'équipe a fait sa deuxième découverte :ClpX sauvage, non mutant, peut également remplir certaines des fonctions de Lon, dans les bonnes conditions.
Il s'avère que ClpX est très sensible à l'ATP, un composé organique qui est la source d'énergie de toutes les cellules vivantes. À des niveaux normaux d'ATP, ClpX se concentre sur ses propres tâches, mais à un seuil spécifique et inférieur, il commence soudainement à nettoyer après Lon.
"Il s'agit d'une véritable percée dans la compréhension de base du fonctionnement des cellules", déclare Chien. "Cela change les règles :non seulement l'énergie cellulaire contrôle la vitesse de fonctionnement d'une cellule, mais aussi son fonctionnement." Le complexe protéique ClpX-ClpP pourrait être le point de départ de nouveaux antibiotiques