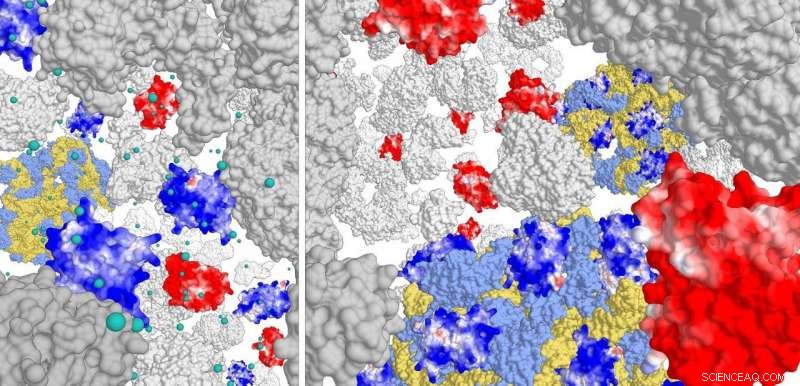
Panneau de droite :interaction des protéines chargées positivement (bleu foncé) avec le complexe ribosomal (bleu clair/jaune). Les protéines chargées négativement n'interagissent pas. À une force ionique élevée (panneau de gauche), les protéines positives interagissent à peine avec le ribosome. Crédit :laboratoire Poolman, Université de Groningue
Les cellules sont remplies de macromolécules, qui limite la diffusion des protéines, en particulier dans les cellules procaryotes sans transport actif dans le cytoplasme. En étudiant la relation entre le surpeuplement, force ionique et diffusion des protéines, Des biochimistes de l'Université de Groningue ont fait une découverte fascinante :des protéines chargées positivement collent à la surface des complexes de ribosomes. Cela explique pourquoi la plupart des protéines hydrosolubles portent une charge globale négative. La découverte paraîtra bientôt dans le journal eLife .
La vitesse de déplacement des protéines à l'intérieur des cellules est importante :de nombreux processus dans les cellules biologiques dépendent des interactions entre les macromolécules (protéines et acides nucléiques) et donc de leur capacité à se retrouver. "Mais le cytoplasme cellulaire est un endroit animé et cela affectera la diffusion des protéines et de l'ARN", remarques Université de Groningen Professeur de biochimie Bert Poolman.
Des charges
Son groupe a étudié les effets du surpeuplement sur la diffusion, et a trouvé une corrélation entre la taille des protéines et la vitesse de diffusion. « Mais pour certaines protéines, nous n'avons pas trouvé cette corrélation, nous avons donc entrepris de rechercher pourquoi. L'équipe a utilisé trois procaryotes différents avec une force ionique croissante :la bactérie à Gram négatif Escherichia coli, le Lactococcus lactis à Gram positif et l'extrêmophile Haloferax volcanii, qui vit à des concentrations très élevées de sel.
Pour cette étude, les chercheurs ont construit différentes variantes de la protéine fluorescente verte (GFP), avec des charges surfaciques allant de -30 à +25. Ils ont ensuite étudié le mouvement de ces variantes de GFP dans les trois types cellulaires. «Nous avons vu que les protéines chargées positivement se diffuseraient très lentement. Ils sont restés coincés dans la cellule', explique Poolman. Une analyse plus poussée a montré que les protéines positives ne se liaient pas à l'ADN ou à la membrane cellulaire mais au complexe ribosomal.
Intéressant
Une analyse bioinformatique des protéomes des micro-organismes et des cellules eucaryotes a montré que dans la plupart des cas, environ 70 pour cent des protéines sont chargées négativement. 'De façon intéressante, les 30 pour cent restants sont soit des protéines membranaires, soit des protéines impliquées dans le fonctionnement ou le repliement du ribosome ou de l'ARNm.'
Les protéines membranaires sont protégées par des chaperons lors de la biogenèse, afin qu'ils ne collent pas aux ribosomes. Il n'y a donc pas de protéines cytoplasmiques « libres » avec une charge positive suffisamment élevée pour les faire se fixer sur les ribosomes. La charge négative du complexe ribosomal et la force ionique ambiante du cytoplasme semblent avoir façonné l'évolution des charges dans le protéome cellulaire.
Inattendu
L'idée nouvelle et inattendue que la mobilité des protéines est fonction de la charge des protéines peut expliquer pourquoi il est difficile d'exprimer certaines protéines dans des systèmes bactériens à faible force ionique. «Nous avons observé qu'une force ionique plus élevée réduit le caractère collant des protéines chargées positivement. Cela pourrait être une idée précieuse pour la construction de plates-formes d'expression de protéines.'
Une dernière observation dans l'article eLife est que les génomes de plusieurs endosymbiotes montrent une abondance de protéines chargées positivement. « Cette découverte nous déconcerte vraiment », admet Poolman. « Vous vous attendriez à ce que toutes ces protéines soient attirées par les ribosomes des endosymbiotes. Jusque là, nous n'avons aucune explication sur la façon dont ces organismes sont capables de gérer une diffusion lente et des ribosomes engloutis par des protéines positives.