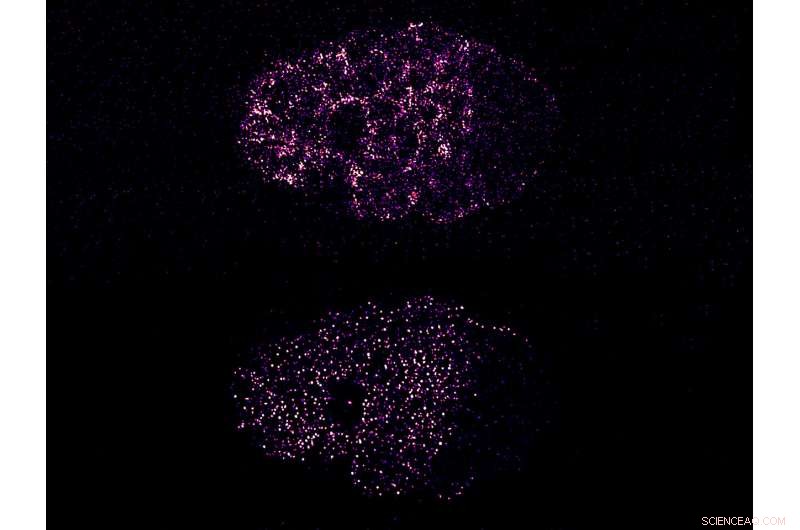
Figure :La contraction entraîne le regroupement des protéines PAR pour briser la symétrie dans un embryon de C. elegans. L'image du haut montre l'activité contractile de la myosine corticale, ce qui provoque le regroupement de la protéine PAR-3 (image du bas). La myosine et le PAR-3 se séparent du côté gauche de l'embryon, le pôle antérieur. Cela rompt la distribution symétrique précédente de ces protéines et polarise la cellule. Crédit :Institut de mécanobiologie, Singapour
Une équipe de chercheurs de l'Institut de Mécanobiologie, Singapour (MBI) à l'Université nationale de Singapour, avec des collègues du Temasek Life Sciences Laboratory et de l'Institut de biologie moléculaire et cellulaire d'A*STAR à Singapour, a découvert un nouveau mécanisme pour établir la polarité cellulaire qui repose sur le regroupement de protéines induit par la force de tension. Ce travail a été publié dans la revue scientifique Nature Biologie Cellulaire en août 2017.
Les forces corticales induisent le regroupement des protéines pour la polarisation cellulaire
Les cellules biologiques sont généralement visualisées sous une forme ronde (ou sphérique), avec un noyau centré au milieu, et d'autres composants cellulaires dispersés partout. En réalité, chaque type cellulaire présente une forme distincte, taille et composition. Les représentations de sphères symétriques sont, en substance, une simplification excessive qui masque le fait que presque toutes les cellules sont asymétriques dans leur composition, et que cette asymétrie se développe par étapes précises et bien ordonnées.
Connue sous le nom de polarité cellulaire, cette caractéristique clé des cellules voit la séparation des composants sous-cellulaires en régions distinctes de la cellule. Si les cellules étaient symétriques, des processus tels que la division et le mouvement des cellules ne se produiraient pas correctement, et les tissus et organes seraient déformés et non fonctionnels. Bien qu'elle fasse partie intégrante du développement de l'organisme, les scientifiques doivent encore définir complètement les processus par lesquels les cellules se polarisent.
Une façon de visualiser la nature asymétrique de la composition cellulaire est de penser aux composants d'une voiture et à la façon dont ils sont disposés. Certaines parties de la voiture doivent être situées dans une disposition équilibrée, par exemple les roues. Les autres composants doivent être disposés dans une orientation spécifique pour fonctionner correctement, c'est-à-dire que le siège du conducteur doit être situé devant les sièges des passagers arrière. Finalement, des composants tels que le moteur peuvent être situés à l'avant ou à l'arrière de la voiture, et surtout, cette organisation confère différentes propriétés à la tenue de route de la voiture. De la même manière, l'arrangement des composants cellulaires peut avoir des effets drastiques sur la fonction cellulaire.
Bon nombre des études existantes sur la polarité cellulaire ont été menées chez le ver nématode C. elegans. Au stade unicellulaire, l'embryon se divise le long d'un axe avant/arrière pour générer deux cellules filles de tailles différentes, avec une cellule plus grande à l'avant et une cellule plus petite à l'arrière. Cet axe avant/arrière est établi par le mouvement et la ségrégation d'un groupe de protéines connues sous le nom de protéines PAR (partition défectueux).
Ces protéines PAR résident dans le cortex cellulaire, une couche dynamique de filaments de protéines qui se trouve juste à l'intérieur de la membrane cellulaire. Avant la polarisation, les protéines PAR sont distribuées dans tout le cortex, où ils se déplacent librement. Pendant la polarisation, le cortex se contracte, et cela provoque la séparation et l'accumulation de différentes protéines PAR à l'avant ou à l'arrière de la cellule, brisant ainsi leur organisation auparavant symétrique et établissant une polarité le long de l'axe avant/arrière. Cependant, le mécanisme par lequel l'activité contractile transporte et sépare les protéines PAR reste incertain.
Flux de tension
L'équipe de chercheurs dirigée par le professeur assistant Fumio Motegi, Chercheur principal au MBI et au Laboratoire des sciences de la vie de Temasek, ont cherché à répondre à cette question en observant le mouvement des complexes protéiques PAR marqués par fluorescence au microscope dans des embryons vivants de C. elegans pendant qu'ils subissaient la polarisation. En utilisant des techniques avancées de microscopie, ils ont découvert que certaines protéines PAR s'assemblaient en amas au début de la polarisation, et ces amas ont augmenté en taille au fur et à mesure que la polarisation progressait. Une fois la contraction corticale arrêtée, les grappes démontées, les protéines s'étalant en gradient le long de l'axe avant/arrière.
Malgré ces constatations, les chercheurs n'ont pas observé de lien direct entre les fibres contractiles et les protéines PAR, et cela les a amenés à émettre l'hypothèse qu'un effet indirect de contraction était responsable du clustering. En perturbant ou en renforçant le cortex d'actomoysine et en observant l'effet sur la formation d'amas, ils ont découvert que la force clé à l'origine du clustering PAR était la tension corticale, qui se développe au fur et à mesure que le cortex se contracte.
À partir de là, les chercheurs ont pu proposer un nouveau modèle expliquant la ségrégation des protéines PAR. Ici, la contraction du cortex d'actomyosine entraîne une augmentation de la tension corticale, provoquant l'assemblage des protéines PAR en grappes. Comme ces grands amas se déplacent lentement, ils sont pris dans le flux cortical global et se séparent à une extrémité de la cellule, établissant ainsi la polarité. Ces amas séparés de protéines PAR agissent alors comme un échafaudage qui médie une accumulation locale d'autres protéines nécessaires à l'établissement d'axes avant/arrière le long du corps.
Le mécanisme découvert dans cette étude est un exemple simple mais élégant de la façon dont les cellules utilisent les forces internes pour déplacer et organiser leurs composants protéiques de manière précise, manière bien ordonnée. Surtout, le mécanisme de force décrit permet à la cellule d'établir une polarité sans gaspiller d'énergie en transportant activement des protéines ou des composants cellulaires contre un gradient de concentration. On pense que des mécanismes similaires sont utilisés pour briser la symétrie dans d'autres organismes, y compris les humains, et on espère que ces nouvelles connaissances aideront les scientifiques à comprendre comment et pourquoi la polarité cellulaire ne parvient pas à être correctement établie dans des maladies telles que la mucoviscidose et le cancer.