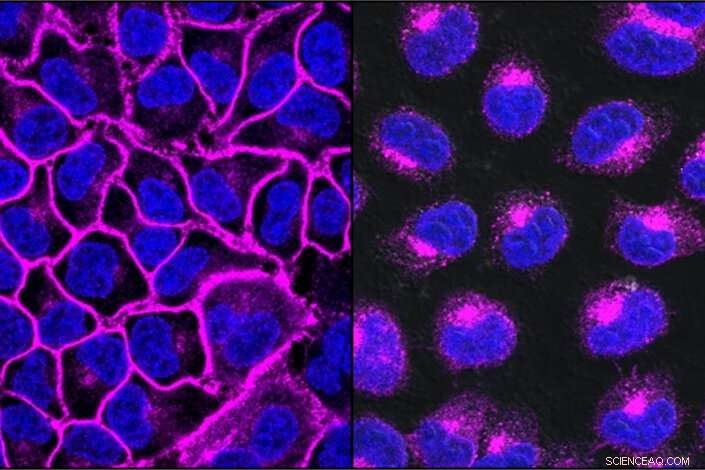
EGFR, une protéine importante pour aider les cancers à se développer, montré ici en violet, décore la surface de la cellule (à gauche). Après traitement avec un LYTAC ciblant l'EGFR, toute la protéine EGFR est transportée dans les lysosomes, les compartiments de dégradation à l'intérieur de la cellule (à droite). Crédit :Steven Banik
Lorsque les scientifiques découvrent une protéine potentiellement dangereuse sur une cellule, ils pourraient imaginer se rétrécir pour devenir de minuscules chirurgiens, en supprimant uniquement la molécule problématique et en laissant intactes les parties saines de la cellule. Alors que des mains habiles et des instruments tranchants ne seraient jamais capables d'exciser une seule protéine de la surface d'une cellule, un nouvel outil moléculaire pourrait faciliter la chirurgie cellulaire, selon une étude publiée dans La nature le 29 juillet.
Les chimistes de Stanford ont développé une nouvelle classe de molécules qui transportent des protéines indésirables de la surface ou de l'environnement environnant d'une cellule dans le lysosome, le compartiment cellulaire dédié à la dégradation des protéines. Ces molécules, appelées chimères ciblant les lysosomes, ou LYTAC, fonctionnent en marquant sélectivement une protéine avec une étiquette qui scelle son destin pour l'élimination des déchets cellulaires. Cette dégradation sélective pourrait aider les chercheurs à étudier et à traiter des maladies comme le cancer et la maladie d'Alzheimer, dont les causes sont liées aux protéines de surface.
"C'est comme un scalpel moléculaire, " a déclaré l'auteur principal Steven Banik, un post-doctorat dans le laboratoire de Carolyn Bertozzi, le professeur Anne T. et Robert M. Bass à la Faculté des sciences humaines. "Cet outil vous permet d'accélérer la dégradation naturelle d'une protéine individuelle parmi toutes les différentes protéines qui se trouvent sur ou à l'extérieur d'une cellule."
Les protéines sont vitales pour de nombreux processus biologiques comme le métabolisme et la communication intercellulaire, mais certains peuvent également aider des maladies comme le cancer à se propager et à échapper à la régulation immunitaire. Les méthodes traditionnelles pour entraver ces mauvais acteurs impliquent l'utilisation de médicaments qui bloquent le site actif de la protéine, où d'autres composants cellulaires peuvent s'arrimer pendant que la protéine agit sur eux, généralement en déplaçant des atomes. Mais cette stratégie de blocage est imparfaite; parfois, la poche de reliure est trop peu profonde et l'inhibiteur se détache trop rapidement. D'autres fois, l'activité d'une protéine découle de ses propriétés physiques, comme sa rigidité, et non d'un site actif, le blocage d'une petite partie de la protéine entière est donc insuffisant. Dans ces cas, le drainage de la cellule de la protéine est la seule option.
La dégradation des protéines en tant que stratégie thérapeutique est particulièrement populaire depuis le développement des PROTAC, ou la protéolyse ciblant les chimères, il y a 20 ans. PROTAC, qui recherchent et marquent les protéines intracellulaires pour la dégradation, ont connu le succès dans les laboratoires de recherche et dans les premières études cliniques, mais ils reposent sur une voie de dégradation inaccessible aux quelque 40 pour cent de toutes les protéines qui se trouvent au sommet ou à l'extérieur d'une membrane cellulaire. Bertozzi et Banik n'acceptaient pas que certaines protéines - et maladies - soient hors de portée.
"Mon laboratoire s'est toujours intéressé à ce qui se passe à la surface des cellules, qui contient toutes ces protéines importantes pour la modulation immunitaire, " dit Bertozzi, qui est également le codirecteur de la famille Baker de Stanford ChEM-H. "Nous avons identifié de nombreuses protéines de surface et sécrétées qui, selon nous, jouent un rôle pathogène dans le cancer, et les LYTAC pourraient nous aider à mieux les comprendre et à les explorer en tant que cibles médicamenteuses. »
La clé pour faire fonctionner l'outil est sa conception bifonctionnelle. Un côté de cette molécule peut être personnalisé pour se lier à n'importe quelle protéine d'intérêt. De l'autre côté se trouve une courte séquence d'acides aminés, ou peptidique, clouté avec un sucre appelé mannose-6-phosphate.
Ce sucre sert d'étiquette comptable pour la cellule. Lorsque la cellule construit des protéines qui appartiennent au lysosome, il cloue sur ces sucres pour s'assurer qu'ils atteignent leur destination. "Le mannose-6-phosphate agit comme un code postal, " dit Banik. " Ces sucres disent à la cellule, « J'apporte cette protéine au lysosome. S'il vous plaît envoyez-moi là-bas.'" Il y a des récepteurs à la surface des cellules qui interagissent avec cette couche de sucre, et quand ils saisissent une molécule de LYTAC et la tirent dans la cellule, les protéines marquées sont entraînées avec elle.
En attachant cette étiquette aux protéines, Les LYTAC détournent un mécanisme de navette cellulaire naturel conçu pour escorter les protéines lysosomales nouvellement synthétisées vers leur nouveau foyer. Mais alors que les protéines lysosomales sont suffisamment résistantes pour survivre aux enzymes de dégradation qu'elles rencontrent dans le lysosome, la plupart des protéines ne le sont pas, donc ceux marqués par la méthode LYTAC sont généralement détruits.
Les chercheurs de Stanford montrent que, dans les cellules, ils peuvent cibler et dégrader des protéines importantes dans la maladie d'Alzheimer et le cancer. Selon eux, l'extrémité d'attache protéique du LYTAC peut être tout ce qui se lie à une protéine, comme un anticorps ou un médicament existant, donc à l'avenir, de nombreuses autres protéines et maladies pourraient être attaquées.
"Avec des stratégies de dégradation des protéines, vous pouvez non seulement étendre ce qui est médicamentable, mais aussi améliorer les thérapies qui existent déjà, " dit Bertozzi. "Chaque cellule a des lysosomes. Chaque cellule a déjà un moyen de dégrader les protéines. Quelle que soit votre cible, si vous pouvez y obtenir un LYTAC, vous pouvez le dégrader."