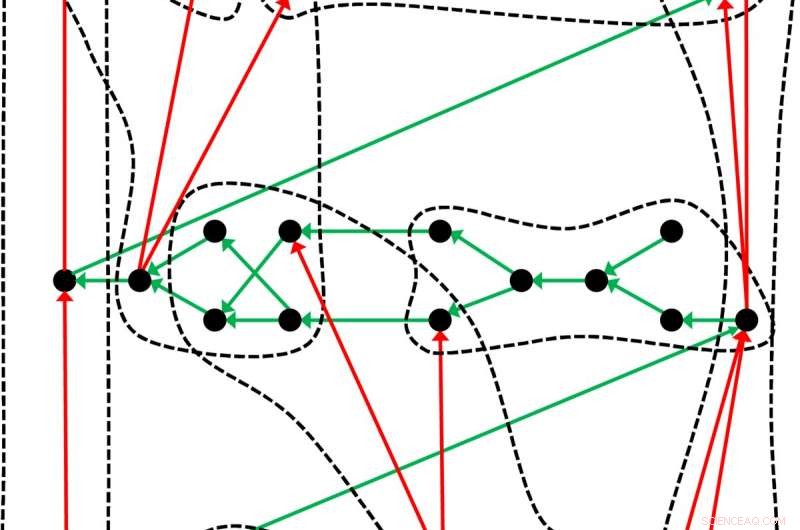
Un tableau périodique légèrement différent :Le tableau des éléments chimiques, qui remonte à Dmitri Mendeleev et Lothar Meyer, n'est qu'un exemple de la façon dont les objets – dans ce cas les éléments chimiques – peuvent être organisés dans un tel système. Les chercheurs de Leipzig illustrent la structure générale d'un tableau périodique avec cet exemple :Les points noirs représentent les objets ordonnés par les flèches vertes. À l'aide d'un critère approprié, les objets peuvent être classés en groupes (lignes pointillées) dans lesquels les flèches rouges créent un sous-ordre. Crédit :Guillermo Restrepo, MPI pour les Mathématiques dans les Sciences
Le tableau périodique des éléments que la plupart des livres de chimie décrivent n'est qu'un cas particulier. Ce tableau récapitulatif des éléments chimiques, qui remonte à Dmitri Mendeleev et Lothar Meyer et aux approches d'autres chimistes pour organiser les éléments, impliquent différentes formes de représentation d'une structure cachée des éléments chimiques. C'est la conclusion à laquelle sont parvenus des chercheurs de l'Institut Max Planck de mathématiques dans les sciences de Leipzig et de l'Université de Leipzig dans un article récent. L'approche mathématique des scientifiques de Leipzig est très générale et peut fournir de nombreux systèmes périodiques différents selon le principe d'ordre et de classification - non seulement pour la chimie, mais aussi pour de nombreux autres domaines de la connaissance.
C'est une icône des sciences naturelles et se trouve dans la plupart des classes de chimie :le tableau périodique des éléments, qui fête cette année ses 150 ans. L'aperçu tabulaire est étroitement lié à Dmitri Mendeleev et Lothar Meyer, deux chercheurs qui, dans les années 1860, créé un arrangement d'éléments basé sur leurs masses atomiques et leurs similitudes. Aujourd'hui, ils sont triés par numéro atomique (qui indique le nombre de protons dans le noyau atomique) de l'hydrogène léger (un proton) à l'oganesson synthétique (118 protons). Les éléments sont également classés en groupes :les atomes d'une même colonne ont généralement le même nombre d'électrons dans leur enveloppe externe.
Tableau périodique dans différentes variantes
A première vue, le tableau périodique semble avoir apporté un ordre sans ambiguïté et définitif aux 118 éléments actuellement connus. Mais les apparences peuvent être trompeuses car beaucoup de choses restent encore controversées :les scientifiques ne s'entendent pas exactement sur les éléments qui appartiennent au troisième groupe en dessous du scandium et de l'yttrium. Par exemple, la position correcte du lanthane et de l'actinium est débattue. Si l'on regarde de plus près, on découvrira des variantes légèrement différentes du tableau périodique dans les salles de classe, salles de conférence, et des manuels scolaires.
Guillermo Restrepo et Wilmer Leal de l'Institut Max Planck de Mathématiques en Sciences et de l'Université de Leipzig ne sont pas surpris. Pour eux, il n'y a pas d'arrangement sans ambiguïté correct des éléments; selon le critère appliqué pour la classification, un tableau périodique différent en résulte. Les atomes peuvent être subdivisés selon la configuration électronique (c'est-à-dire le nombre et la disposition de leurs électrons), leur comportement chimique, leur solubilité, ou leur présence dans des gisements géologiques. Il est maintenant largement admis que les éléments chimiques doivent être classés selon leur numéro atomique et divisés en groupes selon leur configuration électronique. Mais même pour ce tableau périodique, il existe de nombreuses formes différentes de représentation. Par exemple :en spirale avec divers renflements, en forme de pyramide, ou comme une fleur en trois dimensions.
Une structure commune derrière les tableaux périodiques
Guillermo Restrepo et Wilmer Leal ont maintenant systématiquement enquêté sur l'ambiguïté du tableau périodique. Cela a conduit à des découvertes qui sont également d'une importance considérable au-delà de la chimie. Par conséquent, toutes les formes de représentation des éléments chimiques reposent sur une structure commune, que les mathématiciens appellent un hypergraphe ordonné. Le vénérable tableau périodique de Mendeleev et Meyer n'offre donc qu'une représentation de la structure générale, que postulent maintenant Guillermo Restrepo et Wilmer Leal. De nouvelles dispositions peuvent également en découler à tout moment. Guillermo Restrepo compare donc l'ordre des éléments chimiques à une sculpture sur laquelle la lumière tombe de différentes directions. "Les différentes ombres que la figure projette sont les tableaux périodiques. C'est pourquoi il y a tant de façons de créer ces tableaux. D'une certaine manière, les tableaux périodiques sont des projections. Projections de la structure interne du tableau périodique."
Les scientifiques de Leipzig tentent maintenant de déterminer la structure mathématique cachée sur laquelle sont basés les tableaux périodiques connus de la chimie. Pour le moment, ils ont défini trois conditions qui doivent être remplies pour établir un tableau périodique. D'abord, il faut des objets à commander. Pour Mendeleïev, Meyer et les créateurs des autres tableaux périodiques connus de la chimie, ce sont les éléments chimiques. These objects must be arranged according to some properties such as the atomic mass or the atomic number (i.e. the number of protons). Finalement, one criterion is required to group the objects in classes. Mendeleev and Meyer used the chemical similarity for this.

A periodic table of chemical bonds:Each of the 94 circles with chemical element symbols represents the bond that the respective element forms with an organic residue. The bonds are ordered according to how strongly they are polarized. Where there is a direct arrow connection, the order is clear:Bonds of hydrogen, par exemple, are more polarized than bonds of boron, phosphore, and palladium. The same applies to rubidium in comparison to caesium, which has particularly low polarized bonds and is therefore at the bottom of the new periodic table. If there is no direct arrow between two elements, they may still be comparable – if there is a chain of arrows between them. Par exemple, the bonds of oxygen are more polarized than the bonds of bromine. Bonds represented by the same colour have the same binding behaviour and belong to one of the 44 classes. Credit:Guillermo Restrepo, MPI for Mathematics in the Sciences
Periodic table of chemical bonds
"If these three conditions are met, periodic tables can also be created for other chemical objects and even for objects outside chemistry, " says Guillermo Restrepo. He and Wilmer Leal show this by looking at the chemical bonds between atoms of 94 elements and different conjugates. The polarizability of 94 single-covalent bonds, where bonds are arranged according to the electronegativity and atomic radius of one of the bonded atoms. Par exemple, fluor, chlorine, or oxygen are highly electronegative and assume relatively small atomic radii in compounds. The bonds are then classified based on how much they resemble each other.
"We have investigated almost 5, 000 substances consisting of two elements in different proportions, " explains Guillermo Restrepo. "We then looked for similarities within this data. Par exemple, sodium and lithium are similar because they combine with the same elements in the same proportions (e.g. with oxygen or chlorine, brome, and iodine). We thus found patterns we can use to classify the elements."
A periodic table as a network instead of a matrix
In the 44 classes of chemical elements, there are some similarities with the main groups of Mendeleev's and Meyer's periodic table. Par exemple, the alkali metals sodium and lithium are found in one group because they form the same simple salts with halogens such as chlorine or fluorine. Like the elements themselves, the bonds of the four halogens (fluorine, chlorine bromine, and iodine) are also found in the same group. Cependant, there are also classifications that differ significantly from those in the conventional periodic table. Par exemple, carbon and silicon are no longer in the same class because they form very different compounds.
The representation of the periodic table of chemical bonds also has nothing to do with the familiar matrix-like arrangement of the classical periodic tables of the elements. Au lieu, the 94 covalent bonds are represented in a network of differently colored circles. Each circle represents a chemical bond, and the colou symbolizes belonging to one of the 44 groups. Because now two criteria are used for the sorting, there is no longer any clear order of the atoms (like in the tables of Mendeleev and Meyer)—mathematicians speak of a partial order. The circles are therefore connected to other circles by one or more arrows, thereby creating an ordered hypergraph.
Periodic tables in other scientific fields
The chemical elements and their compounds can also be represented in completely different periodic tables—depending on the underlying order and classification principle. What's more:The objects of numerous other scientific fields and their applications can also be arranged in periodic tables. Par exemple, ordered hypergraphs are used in information systems and web mining. Possible periodic systems also emerge when countries are considered; these can be classified according to social or economic indicators as well as geographical proximity or cultural similarity. Other examples can be found in engineering, environmental sciences, sociologie, and many other disciplines. The scientists not only study periodic systems because of their importance for chemistry, mais, par dessus tout, because of their applications in many other disciplines.